Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 2:
\(Đặt.CTTQ.của.A:H_xS_yO_z\left(x,y,z:nguyên,dương\right)\\ Ta.có:\left\{{}\begin{matrix}x=\dfrac{98.2,04\%}{1}=2\\y=\dfrac{98.32,65\%}{32}=1\\z=\dfrac{98.\left(100\%-2,04\%-32,65\%\right)}{16}=4\end{matrix}\right.\\ \Rightarrow x=2;y=1;z=4\\ \Rightarrow CTHH:H_2SO_4\)
Bài 1: Sửa đề 59,2% Al thành 52,9% Al
\(Đặt.CTTQ:Al_xO_y\left(x,y:nguyên,dương\right)\\ x=\dfrac{52,9\%.102}{27}\approx2\\ \Rightarrow y\approx\dfrac{\left(100\%-52,9\%\right).102}{16}\approx3\\ \Rightarrow CTHH:Al_2O_3\)

\(PTK_{KNO_3}=101\left(đvC\right)\\ \Leftrightarrow\left\{{}\begin{matrix}\%_K=\dfrac{39}{101}\cdot100\%=38,61\%\\\%_N=\dfrac{14}{101}\cdot100\%=13,86\%\\\%_O=100\%-38,61\%-13,86\%=47,53\%\end{matrix}\right.\)
Trong hợp chất:
\(\left\{{}\begin{matrix}m_{Cu}=80\cdot80\%=64\left(g\right)\\m_O=80\cdot20\%=16\left(g\right)\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}n_{Cu}=\dfrac{64}{64}=1\left(mol\right)\\n_O=\dfrac{16}{16}=1\left(mol\right)\end{matrix}\right.\)
Vậy CTHH A là \(CuO\)

Vậy x=2, y=3
Công thức hóa học của hợp chất là 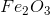
Phân tử khối bằng
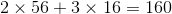
b) Hóa trị của Fe trong hợp chất là : III

tỉ khối hợp chất với H là 23
=> PTK: hợp chất là : 23.2=46g/mol
ta có khối lượng N có trong hợp chất : \(\frac{46}{100}.30,44=14\)g/mol
=> số phân tử N có trong hợp chất là : 14:14=1
=>khối lượng của O trong hợp chất là 46-14=32g/mol
=> số phân tử O trong hợp chất là : 32:16=2
=> công thức của hợp chất là NO2

1. CT của hợp chất : RO2 (do R hóa trị IV)
Ta có : \(\%R=\dfrac{R}{R+16.2}.100=50\)
=> R=32
Vậy R là lưu huỳnh (S), CTHH của hợp chất : SO2
2. CTHH của hợp chất tạo kim loại M ( hóa trị II) với nhóm SO4 là MSO4 (do M hóa trị II)
Ta có : \(\%M=\dfrac{M}{M+96}.100=20\)
=>M=24
Vây M là Magie (Mg), CTHH của hợp chất MgSO4

Công thức chung của hợp chất F e x O y .
Theo đề bài ta có:
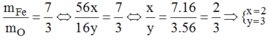
Vậy CTHH của hợp chất là F e 2 O 3 .
Phân tử khối là: 56.2 + 16.3 = 160 (đvC)

CTHH: AxOy
Có: \(\dfrac{x.M_A}{x.M_A+16y}.100\%=70\%\)
=> \(M_A=\dfrac{112y}{3x}=\dfrac{2y}{x}.\dfrac{56}{3}\)
Xét \(\dfrac{2y}{x}\) = 1 => L
Xét \(\dfrac{2y}{x}=2\) => L
Xét \(\dfrac{2y}{x}=3\) => MA = 56 (Fe) => \(\dfrac{x}{y}=\dfrac{2}{3}\) => CTHH: Fe2O3
Ta có:
\(\%A=70\%\rightarrow\%O=100\%-70\%=30\%\)
Theo quy tắc hóa trị mở rộng:
\(\dfrac{70}{MA}.a=\dfrac{30}{16}.2\) với \(a\) là hóa trị của \(M\)
\(\rightarrow\dfrac{70}{MA}.a=3,75\\ \rightarrow\dfrac{70}{MA}=\dfrac{3,75}{a}\\ \rightarrow3,75.M.A=70a\\ \rightarrow MA=18,6.a\)
Bảng biện luận chạy từ \(1->7\)
| \(a\) | \(1\) | \(2\) | \(3\) | \(4\) | \(5\) | \(6\) |
| \(MA=18,6a\) | \(19\left(loại\right)\) | \(38\left(loại\right)\) | \(56\left(nhận\right)\) | \(74\left(loại\right)\) | \(93\left(loại\right)\) | \(112\left(loại\right)\) |
\(\rightarrow\) Với \(a=3\) thì \(MA=56\) là \(Fe\) mang hóa trị \(III\)
\(\rightarrow CTHH\) của \(A\) là \(Fe_2O_3\)

Gọi công thức hoá học của hợp chất là: \(Cu_xS_yO_z\)
Ta có: \(64x:32y:16z=40:20:40\)
\(\Rightarrow x:y:z=\dfrac{40}{64}:\dfrac{20}{32}:\dfrac{40}{16}\)
\(\Rightarrow x:y:z=1:1:4\)
Vậy công thức hoá học đơn giản của hợp chất B là: \(\left(CuSO_4\right)n\)
Ta lại có: \(\left(CuSO_4\right)n=160\)
\(\Rightarrow160n=160\)
\(\Rightarrow n=1\)
Vậy công thức hoá học của hợp chất B là:\(CuSO_4\)

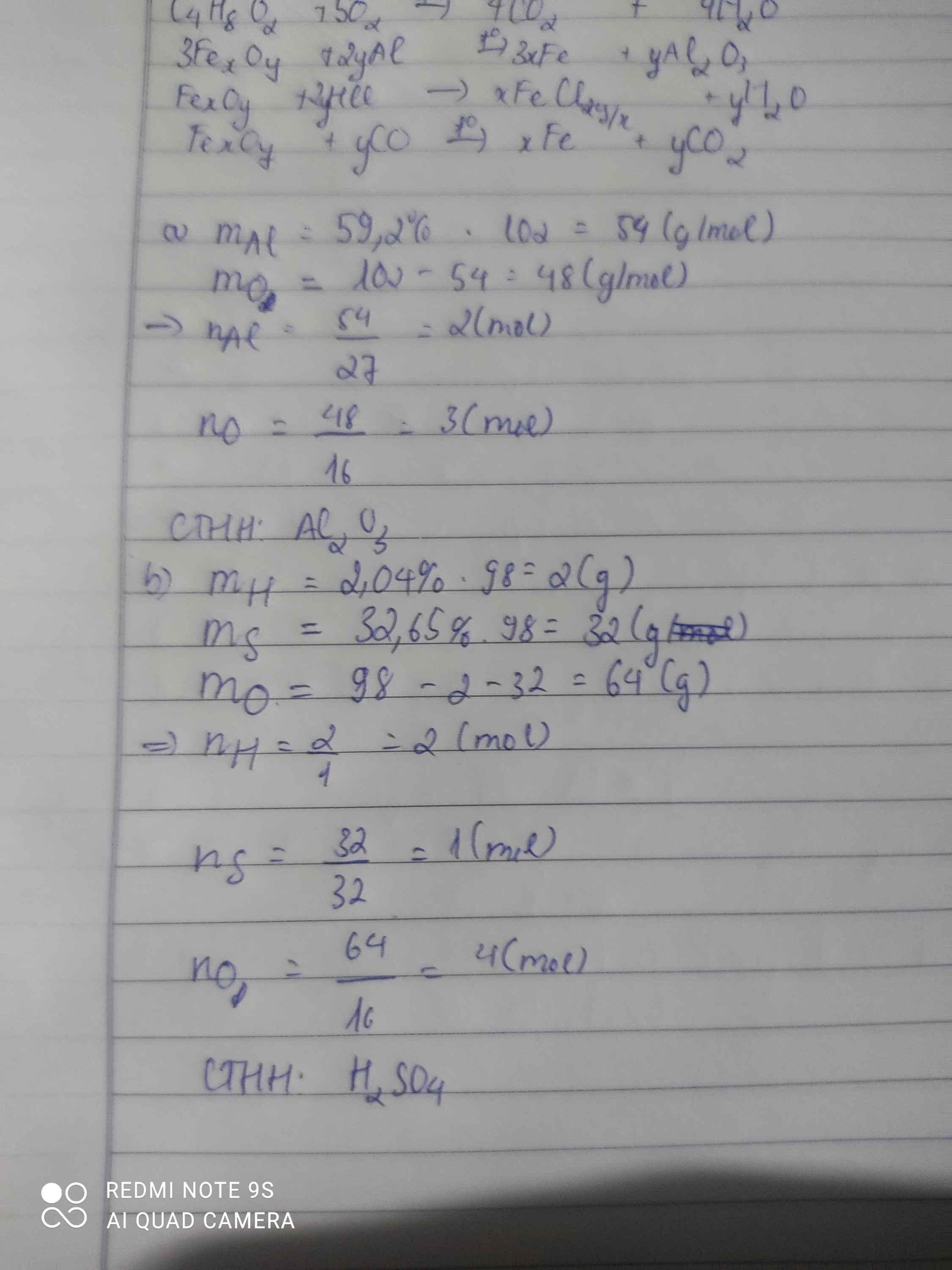

\(m_C=\dfrac{30.80}{100}=24g\\ m_H=30-24=6g\\ \Rightarrow n_C=\dfrac{24}{12}=2mol\\ n_H=\dfrac{6}{1}=6mol\\ \Rightarrow CTHH:C_2H_6\)