Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Sau phản ứng cho hỗn hợp rắn tác dụng với dd NaOH thấy có khí thoát ra, suy ra có Al dư.
Vậy hỗn hợp rắn: Fe, A l 2 O 3 , Al (dư) và F e 2 O 3 (nếu dư).
Theo định luật bảo toàn khối lượng, ta có:
m X = m r ắ n tan + m r ắ n k h ô n g tan
= 21,67 - 12,4 = 9,27g
Mà m r ắ n tan = m A l d u + m A l 2 O 3
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2 1
Theo PTHH (1), ta có:
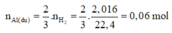
⇒ m A l d u = 0,06.27 = 1,62g
⇒ m A l 2 O 3 p u = m r a n tan - m A l d u
= 9,27-1,62=7,65 g
⇒ n A l 2 O 3 p u = 0,075mol
⇒ n A l p u = n F e s p = 2 n A l 2 O 3 p u
= 0,075.2 = 0,15 mol
Ta có:
m ran khong tan = mFe (sp) = mFe2O3(neu dư)
⇒ m F e 2 O 3 (neu dư)=12,4-0,15.56 = 4g
⇒ n F e 2 O 3 dư = 4/160 = 0,025 mol
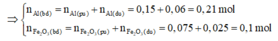
Giả sử phản ứng hoàn toàn thì Al sẽ dư → Tính hiệu suất phản ứng nhiệt nhôm theo F e 2 O 3 .
⇒ H = 0,075.100/0,1 = 75%
⇒ Chọn D.

PTHH:
\(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\)
0,15 0,15
\(CaO+2HCl\rightarrow CaCl_2+H_2O\)
Ta có: \(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}=0,15\cdot100=15\left(g\right)\)
\(\Rightarrow m_{CaO}=20,6-15=5,6\left(g\right)\)
\(\Rightarrow\%m_{CaCO_3}=\dfrac{15\cdot100}{20,6}\approx73\%\)
\(\Rightarrow\%m_{CaO}=100\%-73\%=27\%\)

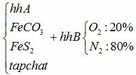
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
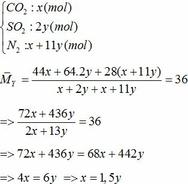
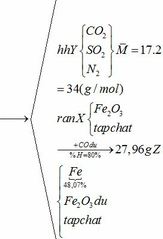
Khối lượng Fe có trong Z là:
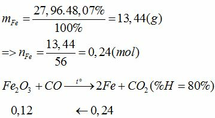
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
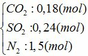
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
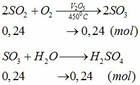
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
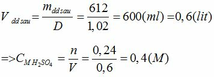

Áp dụng định luật BTKL :
\(m_{CO_2}=142-76=66\left(g\right)\)
\(n_{CO_2}=\dfrac{66}{44}=1.5\left(mol\right)\)
\(V_{CO_2}=1.5\cdot22.4=33.6\left(l\right)\)
\(n_{CaCO_3}=a\left(mol\right),n_{MgCO_3}=b\left(mol\right)\)
\(m_X=100a+84b=142\left(g\right)\left(1\right)\)
\(CaCO_3\underrightarrow{^{^{t^0}}}CaO+CO_2\)
\(MgCO_3\underrightarrow{^{^{t^0}}}MgO+CO_2\)
\(m_Y=56a+40b=76\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=1,b=0.5\)
\(\%CaO=\dfrac{56\cdot1}{76}\cdot100\%=73.68\%\)
\(\%MgO=100-73.68=26.32\%\)
PTHH: \(CaCO_3\xrightarrow[]{t^o}CaO+CO_2\uparrow\)
a_______a_____a (mol)
\(MgCO_3\xrightarrow[]{t^o}MgO+CO_2\uparrow\)
b_______b_____b (mol)
Ta lập hệ phương trình: \(\left\{{}\begin{matrix}100a+84b=142\\56a+40b=76\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=1\\b=0,5\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CaO}=\dfrac{56}{76}\cdot100\%\approx73,68\%\\\%m_{MgO}=26,32\%\\V_{CO_2}=\left(1+0,5\right)\cdot22,4=33,6\left(l\right)\end{matrix}\right.\)

Cho HCl vào Z thấy có khi thoát ra → Z gồm KOH và K2CO3.
Gọi: \(\left\{{}\begin{matrix}n_{KOH}=x\left(mol\right)\\n_{K_2CO_3}=y\left(mol\right)\end{matrix}\right.\) (trong 1/2Z)
- Cho pư với Ca(HCO3)2:
\(HCO_3^-+OH^-\rightarrow CO_3^{2-}\)
__________x________x (mol)
\(Ca^{2+}+CO_3^{2-}\rightarrow CaCO_3\)
________x+y________x+y (mol)
\(\Rightarrow x+y=\dfrac{3}{100}=0,03\left(mol\right)\left(1\right)\)
- Cho pư với HCl.
\(H^++OH^-\rightarrow H_2O\)
x______x (mol)
\(H^++CO_3^{2-}\rightarrow HCO_3^-\)
y_______y________y (mol)
\(H^++HCO_3^-\rightarrow CO_2+H_2O\)
y_________y (mol)
⇒ nH+ = x + 2y = 0,2.2 = 0,04 (mol) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,02\left(mol\right)\\y=0,01\left(mol\right)\end{matrix}\right.\)
→ Z gồm: 0,04 (mol) KOH và 0,02 (mol) K2CO3
BTNT K, có: nKHCO3 = nKOH + 2nK2CO3 = 0,08 (mol)
BTNT OH: nCa(OH)2 = 1/2nKOH = 0,02 (mol)
BTNT Ca: nCaCO3 = nCaO = nCa(OH)2 = 0,02 (mol)
⇒ m = 0,08.100 + 0,02.100 = 10 (g)




\(n_{KMnO_4\left(pư\right)}=a\left(mol\right)\)
\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(a............0.5a.........0.5a....0.5a\)
Bảo toàn khối lượng :
\(m_{O_2}=79-72.6=6.4\left(g\right)\)
\(\Rightarrow a=\dfrac{6.4}{32}:0.5=0.4\left(mol\right)\)
\(H\%=\dfrac{0.4\cdot158}{79}\cdot100\%=80\%\)
\(b.\)
\(m_{K_2MnO_4}=0.2\cdot197=39.4\left(g\right)\)
\(m_{MnO_2}=0.2\cdot87=17.4\left(g\right)\)
\(\%K_2MnO_4=\dfrac{39.4}{72.6}\cdot100\%=54.27\%\)
\(\%MnO_2=\dfrac{17.4}{72.6}\cdot100\%=23.97\%\)
\(\%KMnO_{4\left(dư\right)}=100-54.27-23.97=21.76\%\)
a)
Bảo toàn khối lượng : $m_{O_2} = 79 - 72,6 = 6,4(gam)$
$n_{O_2} = \dfrac{6,4}{32} = 0,2(mol)$
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
$n_{KMnO_4} = 2n_{O_2} = 0,4(mol)$
$H = \dfrac{0,4.158}{79}.100\% = 80\%$
b)
$n_{K_2MnO_4} = n_{MnO_2} = n_{O_2} = 0,2(mol)$
$\%m_{K_2MnO_4} = \dfrac{0,2.197}{72,6}.100\% = 54,27\%$
$\%m_{MnO_2} = \dfrac{0,2.87}{72,6}.100\% = 23,97\%$
$\%m_{KMnO_4} = 100\% -54,27\% - 23,97\% = 21,76\%$