Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\\ Đặt:n_{Al\left(pứ\right)}=x\left(mol\right)\\ m_{tăng}=m_{Cu\left(sinhra\right)}-m_{Al\left(pứ\right)}=\dfrac{3}{2}x.64-x.27=25,69-25\\ \Rightarrow x=0,01\left(mol\right)\\ \Rightarrow n_{CuSO_4\left(dư\right)}=0,2.0,5-0,01.\dfrac{3}{2}=0,085\left(mol\right)\\ n_{Al_2\left(SO_4\right)_3}=0,01\left(mol\right)\\ CM_{Al_2\left(SO_4\right)_3}=\dfrac{0,01}{0,2}=0,05\left(M\right)\\ CM_{CuSO_4\left(dư\right)}=\dfrac{0,085}{0,2}=0,475M\)

Al: 25 gam + 0,1 mol CuSO4 → thanh nhôm nặng 25,69 gam.
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Sau phản ứng mtăng = 25,69 - 25 = 0,69 gam
=> \(n_{Al} = 2. \dfrac{0,69}{3 .64 - 2 . 27} = 0,01 mol\)
=> nAl2(SO4)3 = 0,005 mol; nCuSO4dư = 0,1 - 0,015 = 0,085 mol
=> CM Al2(SO4)3= 0,025 M; CM CuSO4 = 0,425 M

a) \(m_{tăng}=32,85-16,2=16,65\left(g\right)\\3 CuSO_4+2Al\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
Gọi x là số mol Al phản ứng
=> \(n_{Cu}=\dfrac{3}{2}n_{Al}=1,5x\left(mol\right)\)
Ta có: \(m_{tăng}=1,5x.64-27x=16,65\left(g\right)\)
=> \(x=\dfrac{111}{460}\left(mol\right)\)
=> \(m_{Al\left(pứ\right)}=\dfrac{111}{460}.27=6,52\left(g\right)\); \(m_{Cu}=\dfrac{111}{460}.1,5.64=23,17\left(g\right)\)
b) \(m_{ddsaupu}=6,52+512-23,17=495,35\left(g\right)\)
\(n_{CuSO_4\left(pư\right)}=\dfrac{512.25\%}{160}=0,8\left(mol\right)\)
=> \(n_{CuSO_4\left(dư\right)}=0,8-\dfrac{111}{460}.1,5=\dfrac{403}{920}\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=\dfrac{111}{920}\left(mol\right)\)
=> \(C\%_{CuSO_4}=14,15\%;C_{Al_2\left(SO_4\right)_3}=8,33\%\)

Câu này mình trả lời rồi, bạn xem ở link sau :
https://hoc24.vn/cau-hoi/nhung-mot-la-nhom-nang-162g-vao-512g-dung-dich-cuso4-25-sau-mot-thoi-gian-lay-la-nhom-ra-khoi-dung-dich-can-lai-thay-nang-3285g-con-lai-dung-dich-aa-tinh-khoi-luong-al-da-pu-va-khoi-luong-cu.1706643518303

2Al + 3CuSO4 = Al2(SO4)3 + 3Cu.
Cứ 54 gam nhôm phản ứng tạo ra 192 gam Cu làm khối lượng thanh nhôm tăng lên 138 gam.
Khối lượng thanh nhôm của bạn chỉ tăng 1,38 gam tức là chỉ có 1,92 gam đồng thoát ra.

Bài 1
2Al+3CuSO4→Al2(SO4)3+3Cu
a-------------------------------------1,5a
Đặt a là số mol của Al pư
Độ tăng của thanh Al sau khi lấy thanh ra khỏi dd:
46,38−45=1,38(g)
⇒96a−27a=69a=1,38
⇒a=0,02⇒a=0,02
⇒mCu=1,92(g)
Câu 1:
2Al + 3Cu2+ --> 2Al3+ + 3Cu
x............1,5x.........................1,5x
m sau – m trước = 64 . 1,5x – 27x = 46,38 – 45
=> x = 0,02 => m Cu phản ứng = 1,5 . 0,02 . 64 = 1,92g
Câu 2:
mAgNO3 = 340 . 6% = 20,4g => nAgNO3 = 0,12mol
Khối lượng AgNO3 giảm 25% chính là lượng AgNO3 phản ứng
=> nAgNO3 phản ứng = 0,12 . 25% = 0,03
Cu + 2AgNO3 ---> Cu(NO3)2 + 2Ag
0,015..........0,03.....................................0,03
m vật = 15 + (0,03.108 - 0,015.64) = 17,28 (g)

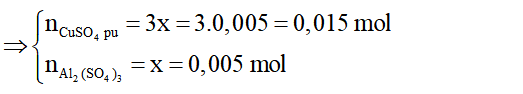
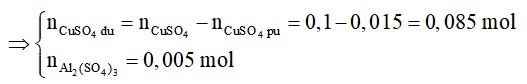
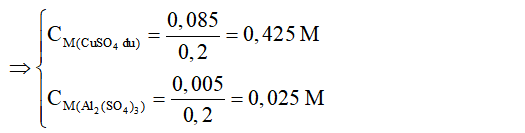

n C u S O 4 = 0,5.0,2 = 0,1 mol
2 A l + 3 C u S O 4 → A l 2 S O 4 3 + 3 C u
2x……3x……..x……3x (Mol)
Theo bài ta có:
m C u b á m v à o - m A l tan = m A l t ă n g
⇔ 3x.64 - 2x.27 = 25,69 - 25
⇔ 138x = 0,69
⇔ x = 0,005 mol
⇒ Chọn D.