Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Fe2O3 + 3CO -> 2Fe + 3CO2 (1)
Fe + CuSO4 -> FeSO4 + Cu (2)
Đặt nFe=a
Ta có:
mCu-mFe=2
64a-56a=2
=>a=0,25
mFe=56.0,25=14(g)
mFe sinh ra ở 1=25,2-14=11,2(g)
nFe(1)=0,2(mol)
Theo PTHH ta có:
nFe2O3=\(\dfrac{1}{2}\)nFe=0,1(mol)
mFe2O3=160.0,1=16(g)
%mFe=\(\dfrac{14}{14+16}.100\%=46,7\%\)
%mFe2O3=100-46,7=53,3%

khi dùng CO khử oxit thì nCO = nO(trong oxit)
mO(trong oxit) = mhỗn hợp -mFe = 11,6 - 9,52 = 2,08g
Quy đổi hỗn hợp oxit ban đầu về hỗn hợp chỉ có Fe và O
Gọi x, y lần lượt là số mol của No, NO2
✱ Xác định % số mol của NO, NO2 có trong hỗn hợp
giả sử hỗn hợp có 1 mol
x + y = 1
30x + 46y = 19.2.1
⇒ x = 0,5
y = 0,5
vậy số mol của 2 khí trong hỗn hợp bằng nhau ⇒ x = y (1)
✱ áp dụng đinh luật bảo toàn e, vì sau phản ứng với HNO3 thì sắt sẽ lên Fe+3 , nFe = 9,52/56 = 0,17 mol
Fe ➝ Fe+3 3e O + 2e ➞ O-2
0,17→ 0,51 0,13 →0,26
N+5 + 3e ➜ N+2
3x← x
N+5 + 1e ➜ N+4
y ← y
tổng số mol e nhường = tổn g số mol e nhận
⇒ 0,51 = 0,26 + 3x + y (2)
từ (1) và (2) ⇒ x = y = 0,0625 mol
V = 22,4 (0,0625 + 0,0625)= 2,8l

bảo toàn e,ta có:
Fe(0)--->Fe(3+) +3e; S(+6)---S(+4) +2e;
Cu(0)---> Cu(2+) +2e;
gọi số mol của Fe và Cu lần lượt là x và y thì ta có:
3x+2y=2*nSO2=2*0,3=0,6;
56x + 64y =15,2;
suy ra x=0,1;y=0,15;
%Cu =0,15*64/15,2=63,16%;
%Fe=100%-63,16%=36,84%
mH2SO4 phản ứng là = 6*nFe+2*nCu=0,9(mol);
---> khối lương H2SO4 đã dùng là 0,9*98*110/100=97.02 g
khối lượng dd H2SO4 đã dùng là 97,02/98%=99g.

HH { Fe , Fe2O3) qua phản ứng với HCl và NaOH. Rồi lấy kết tủa nung nóng trong không khí dc lượng chất rắn không đổi chính là Fe2O3 ( 2Fe(OH)3 -> Fe2O3 + H2O)
Vậy ta thấy hh ban đầu là { Fe , Fe2O3} và hh sau cùng là Fe2O3 đều là hợp chất của Fe. Áp dụng định luật bảo toàn nguyên tố ta sẽ có:
Số mol Fe trong hh ban đầu = số mol Fe ở hh sau cùng.
**Muốn tình tổng số mol Fe ở hh ban đầu cần số mol Fe và nFe2O3:
Biết Fe + 2HCL -> FeCl2 + H2
.......0,05<------------------1.12/22,4 = 0,05 mol
=>mFe trong hh đầu là : 0,05 *56 = 2,8 (g)
=>nFe2O3 trong hh đầu là (10 - 2,8)/160 = 0,045 mol
=> nFe có trong Fe2O3 của hh ban đầu là : 0,045 *2 = 0,09 (mol)
Vậy tổng số mol của Fe trong hh ban đầu là : 0,09 + 0,05 = 0,14 mol
Và 0,14 mol đó cũng chính là n Fe trong hh thu sau cùng. Nhưng đề bài cần mình tính m Fe2O3 thu sau cùng nên ta cần biết n Fe2O3
Biết nFe2O3 = 1/2 * nFe (trong Fe2O3) = 0,14 / 2 = 0,07 (mol)
=> Khối lượng chất rắn Y là : 0,07 * 160 =11,2 (g)
**** Lưu ý: dựa vào pt sau mà nãy giờ ta có thể tính dc số mol Fe trong Fe2O3 và ngc lại có nFe2O3 tính dc số mol Fe : Fe2O3 -> 2Fe + 3/2 O2

Quy đổi hỗn hợp X : Cu: a mol, O: b mol
⇒ 64a+16b=35,6 (1)
nSO2=\(\dfrac{6,72}{22,4}=0,3\) mol
Cu→Cu2+ + 2e
a → 2a
O + 2e → O2-
b → 2b
S6+ + 2e → S4+
0,6 ← 0,3
Bte: 2a - 2b=0,6 (2)
Từ (1), (2) ⇒\(\left\{{}\begin{matrix}a=0,505\\b=0,205\end{matrix}\right.\)
⇒ m= 0,505 . 64 = 32,32g
Quy đổi hh gồm Cu (a mol) và O (b mol)
Theo bài ra: \(64a+16b=35,6\) (1)
Ta có: \(n_{SO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Bảo toàn electron: \(2n_{Cu}=2n_O+2n_{SO_2}\) \(\Rightarrow2a-2b=0,6\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,505\\b=0,205\end{matrix}\right.\)
\(\Rightarrow m_{Cu}=0,505\cdot64=32,32\left(g\right)\)
\(\Rightarrow\) Đáp án B





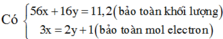
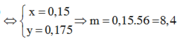

Coi hỗn hợp X gồm Fe và O.
Ta có: 56nFe + 16nO = 28,16 (1)
\(n_{SO_2}=\dfrac{5,9496}{24,79}=0,24\left(mol\right)\)
BT e, có: 3nFe = 2nO + 2nSO2 ⇒ 3nFe - 2nO = 0,24.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,4\left(mol\right)\\n_O=0,36\left(mol\right)\end{matrix}\right.\)
⇒ m = mFe = 0,4.56 = 22,4 (g)
Cái chổ phương trình hai là sao ạ em chưa hiểu lắm