Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học của phản ứng:
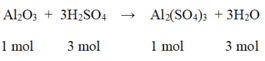
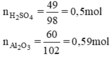
So sánh tỉ lệ 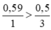 → Vậy Al2O3 dư
→ Vậy Al2O3 dư
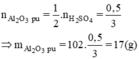
mAl2O3 (dư) = 60 - 17 = 43(g)

`a)`
`Fe + H_2 SO_4 -> FeSO_4 + H_2`
`0,4` `0,4` `0,4` `(mol)`
`n_[Fe]=[22,4]/56=0,4(mol)`
`b)m_[FeSO_4]=0,4.152=60,8(g)`
`c)V_[H_2]=0,4.22,4=8,96(l)`

\(a,n_{Fe}=\dfrac{22,4}{56}=0,4(mol)\\ n_{H_2SO_4}=\dfrac{24,5}{98}=0,25(mol)\\ Fe+H_2SO_4\to FeSO_4+H_2\\ LTL:\dfrac{0,4}{1}>\dfrac{0,25}{1}\Rightarrow Fe\text{ dư}\\ n_{Fe(dư)}=0,4-0,25=0,15(mol)\\ \Rightarrow m_{Fe(dư)}=0,15.56=8,4(g)\\ \)
\(b,m_{dư}=m_{Fe(dư)}=8,4(g)\\ c,n_{H_2}=0,25(mol)\\ \Rightarrow V_{H_2}=0,25.22,4=5,6(l)\\ d,n_{FeSO_4}=0,25(mol)\\\Rightarrow m_{FeSO_4}=0,25.152=38(g)\)

PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Ta có: \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2SO_4}=0,15\left(mol\right)=n_{H_2}\\n_{Al_2\left(SO_4\right)_3}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{H_2SO_4}=0,15\cdot98=14,7\left(g\right)\\m_{Al_2\left(SO_4\right)_3}=0,05\cdot342=17,1\left(g\right)\\V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\end{matrix}\right.\)
a) \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
______0,1--->0,15-------->0,05------->0,15
=> mH2SO4 = 0,15.98 = 14,7 (g)
b) VH2 = 0,15.22,4 = 3,36 (l)
c) mAl2(SO4)3 = 0,05.342 = 17,1 (g)

Sửa lại câu c .
\(n_{H_2SO_4}=\dfrac{49.40}{100}:98=0,2\left(mol\right)\)
\(PTHH:\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
trc p/u : 0,3 0,2
p/u : 0,2 0,2 0,2 0,2
sau : 0,1 0 0,2 0,2
-> Fe dư
\(m_{ddFeSO_4}=0,3.56+49-0,4=65,4\left(g\right)\) ( ĐLBTKL )
\(m_{FeSO_4}=0,2.152=30,4\left(g\right)\)
\(C\%=\dfrac{30,4}{65,4}.100\%\approx46,48\%\)
PTHH :
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,3 0,3 0,3 0,3
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(a,m_{Fe}=0,3.56=16,8\left(g\right)\)
\(b,C_M=\dfrac{n}{V}=\dfrac{0,3}{0,2}=1,5M\)
\(c,n_{H_2SO_4}=\dfrac{\dfrac{49.40}{100}}{98}=0,2\left(mol\right)\)
\(\rightarrow n_{FeSO_4}=n_{H_2SO_4}=0,2\left(mol\right)\)
\(m_{FeSO_4}=0,2.152=30,4\left(g\right)\)
\(m_{ddFeSO_4}=49+\left(0,2.56\right)-0,2.2=59,8\left(g\right)\)( định luật bảo toàn khối lượng )
\(C\%=\dfrac{30,4}{59,8}.100\%\approx50,84\%\)

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Ag}=y\left(mol\right)\end{matrix}\right.\Rightarrow27x+108y=4,2\left(1\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,1 0,05 0,15
\(\Rightarrow m_{Al}=0,1\cdot27=2,7g\)
\(\Rightarrow m_{Ag}=4,2-2,7=1,5g\)
a)\(\%m_{Al}=\dfrac{2,7}{4,2}\cdot100\%=64,28\%\)
\(\%m_{Ag}=100\%-64,28\%=35,72\%\)
b)\(m_{muối}=0,05\cdot342=17,1g\)


nFe3O4=m/M=3,84/232\(\approx0,017\)(mol)
nH2SO4=m/M=3,92/98=0,04(mol)
pthh:
Fe3O4 + 4H2SO4 -> FeSO4 + Fe2(SO4)3 + 4H2O
1...............4..................1................1....................4 (mol)
0,01 <-0,04 -> 0,01 -> 0,01 ->0,04 (mol)
Muối tạo thành là FeSO4 và Fe2(SO4)3
=> mFeSO4=n.M=0,01.152=1,52(g)
\(m_{Fe_2\left(SO_4\right)_3}=n.M=0,01.400=4\left(g\right)\)
b) Theo câu b thì
=> md d H2SO4=\(\dfrac{m_{H_2SO_4}.100\%}{C\%}=\dfrac{0,04.98.100}{19,6}=20\left(g\right)\)
=> md d sau phản ứng =mFe3O4 +mH2SO4=3,84+20=23,84(g)
=> \(C\%_{FeSO_4}=\dfrac{m_{FeSO_4}.100\%}{m_{ddsauphanung}}=\dfrac{1,52.100}{23,84}=\approx6,38\left(\%\right)\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{m_{Fe_2\left(SO_4\right)_3}.100\%}{m_{ddsauphanung}}=\dfrac{4.100}{23,84}\approx16,77\left(\%\right)\)