Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,PTHH:S+O_2\underrightarrow{t^o}SO_2\left(1\right)\)
\(n_S=\dfrac{m}{M}=\dfrac{9,6}{32}=0,3\left(mol\right)\)
\(Theo.PTHH\left(1\right):n_O=n_S=0,3\left(mol\right)\)
\(PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\\ Theo.PTHH\left(2\right):n_{KClO_3}=\dfrac{2}{3}.n_{O_2}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ m_{KClO_3}=n.M=0,2.122,5=24,5\left(g\right)\)
\(b,V_{O_2\left(đktc\right)}=n.22,4=0,2.22,4=4,48\left(l\right)\\ \Rightarrow V_{kk\left(đktc\right)}=5.V_{O_2}=5.4,48=22,4\left(l\right)\)

\(n_{Fe_3O_4}=\dfrac{m_{Fe_3O_4}}{M_{Fe_3O_4}}=\dfrac{4,64}{232}=0,02mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,06 0,04 0,02 ( mol )
\(m_{Fe}=n_{Fe}.M_{Fe}=0,06.56=3,36g\)
\(m_{O_2}=n_{O_2}.M_{O_2}=0,04.32=1,28g\)
\(pthh:3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\)
Theo pt: \(n_{Fe}=3.0,02=0,06\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,06.56=3,36\left(g\right)\)
Theo pt: \(n_{O_2}=2.0,02=0,04\left(mol\right)\)
\(\Rightarrow m_{O_2}=0,04.32=1,28\left(g\right)\)

a) PTHH : \(S+O_2->SO_2\)
b) Ta có : \(n_S\) = \(\dfrac{m_S}{M_S}\) = 0.1 (mol)
Có : \(n_S=n_{O_2}\)
--> \(n_{O_2}\) = 0.1 (mol)
=> \(V_{O_2\left(đktc\right)}\) = \(n_{O_2}\) . 22.4 = 2.24 (L)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\\ PTHH:S+O_2\underrightarrow{t^o}SO_2\\ \left(mol\right)..0,1\rightarrow0,1..0,1\\ V_{O_2}=0,1.22,4=2,24\left(l\right)\)

bài tập 2
3Fe + 2O2 -\(-^{t^o}->\) Fe3O4 (1)
ADCT n= m/M
\(n_{fe_3O_4}\)= 11,6/ 232= 0,05 mol
Theo pt(1) có
\(\dfrac{n_{O2}}{n_{Fe3O4}}\)=\(\dfrac{2}{1}\)
-> \(n_{O2}\)= 2/1 x \(n_{fe3o4}\)
= 0,1 mol
ADCT V= n x 22,4
Vo2= 0,1 x 22,4
= 2,24 (l)
bài tập 4
OXIT AXIT:
- CO2: Cacbon đi oxit
- N2O: đi ni tơ oxit
- SO3: Lưu huỳnh tri oxit
- CO: cacbon oxit
P2O5: đi photpho penta oxit
NO2: Nitơ đi oxit
OXIT BA ZƠ
- HgO: thủy ngân (II) oxit
- MgO: Magie oxit
- FeO: sắt (II) oxit
- Li2O: liti oxit
-CaO: canxi oxit
- BaO: bari oxit
- Na2O: natri oxit
- Al2O3 : Nhôm oxit
ZnO: kẽm oxit

a.b.\(n_{Fe}=\dfrac{6,72}{56}=0,12mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,12 0,08 ( mol )
\(V_{O_2}=0,08.22,4=1,792l\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
4/75 0,08 ( mol )
\(m_{KClO_3}=\dfrac{4}{75}.122,5=6,533g\)
nFe = 6,72 : 56 = 0,12 (mol)
pthh : 3Fe + 2O2 -t--> Fe3O4
0,12 --> 0,08 (mol)
=> VO2 = 0,08 . 22,4 = 1,792 (L)
pthh: 2KClO3 -t--> 2KCl + 3O2
0,053<------------------ 0,08 (mol)
=> mKClO3 = 0,053 . 122,5 = 6,53 (G)

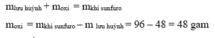

Kết quả của thí nghiệm 1: Đun nóng KMnO4.
1) Hiện tượng: Chất rắn trong ống nghiệm chuyển dần thành màu đen, tàn đóm đỏ bùng cháy.
2) Viết phương trình hóa học:
2KMnO4 → K2MnO4 + MnO2 + O2
3) Giải thích:
Khi đun nóng kalipemaganat bị phân hủy tạo ra khí oxi.
Vì khí oxi duy trì sự cháy nên làm cho tàn đóm đỏ bùng cháy.
Chất rắn màu đen là MnO2
Kết quả của thí nghiệm 2: Đốt cháy lưu huỳnh trong không khí và trong khí oxi.
1) Hiện tượng:
- Trong không khí lưu huỳnh cháy với ngọn lửa nhỏ màu xanh nhạt.
- Trong khí oxi lưu huỳnh cháy mãnh liệt hơn.
- Tạo ra chất khí mùi hắc là lưu huỳnh đioxit.
2) Phương trình hóa học:
S + O2 → SO2.
3) Giải thích: Vì trong lọ đựng oxi sự tiếp xúc của các phân tử lưu huỳnh với các phân tử oxi nhiều hơn trong không khí nên sự cháy xảy ra mãnh liệt hơn.
4) Kết luận: Ở nhiệt độ cao oxi dễ dàng phản ứng với phi kim tạo ra oxit axit.