Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
nH+ = 0,2.0,1 + 0,2.2.0,05 = 0,04
Sau phản ứng thu được 500ml dung dịch có pH =13 ⇒ nOH- lúc sau = 0,05
⇒ nBa =1/2 nOH- ban đầu = 0,045 ⇒ a = 0,045 ÷ 0,3 = 0,15
nH2SO4 = 0,2.0,05 = 0,01< n Ba = 0,045 ⇒ n↓ = n H2SO4 = 0,01 mol
⇒ m↓ = 2,33g
Đáp án A.

Đáp án B
Ta có: nHCl = 0,036 mol, nHNO3 = 0,036 mol, nH2SO4 = 0,024 mol
⇒ ∑nH+ = 0,12 mol || ∑nOH– = 0,08×2×V + 0,23×V = 0,39V.
+ Vì pH = 2 ⇒ Sau pứ trung hòa nH+ dư = 102×(0,36+V) = 0,01V + 0,0036
+ Ta có: ∑nH+ = ∑nOH– + nH+ dư ⇔ 0,12 = 0,39V + 0,01V + 0,0036.
Û V = 0,291 lít ⇒ nBa(OH)2 = 0,02328 mol.
+ Vì nBa2+ < nSO42– ⇒ m↓ = mBaSO4 = 0,02328×233 ≈ 5,42 gam

a, \(n_{HCl}=0,2.0,1=0,02\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(n_{H_2SO_4}=0,2.0,15=0,03\left(mol\right)=n_{SO_4^{2-}}\) \(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,06\left(mol\right)\)
\(\Rightarrow\Sigma n_{H^+}=0,02+0,06=0,08\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,3.0,05=0,015\left(mol\right)=n_{Ba^{2+}}\)
\(\Rightarrow n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,03___0,03 (mol) ⇒ nH+ dư = 0,05 (mol)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,015___0,015______0,015 (mol) ⇒ nSO42- dư = 0,015 (mol)
⇒ m = mBaSO4 = 0,015.233 = 3,495 (g)
\(\left[Cl^-\right]=\dfrac{0,02}{0,2+0,3}=0,04\left(M\right)\)
\(\left[H^+\right]=\dfrac{0,05}{0,2+0,3}=0,1\left(M\right)\)
\(\left[SO_4^{2-}\right]=\dfrac{0,015}{0,2+0,3}=0,03\left(M\right)\)
b, pH = -log[H+] = 1

| Lương Tuấn Dũng | +1đ điểm giá trị | |
| Thứ 4, ngày 20/09/2017 22:07:04 | |
| Chat Online |
+nNaOH=0.1*0.3=0.03(mol)=nOH{-}
+nBa(OH)2=0.025*0.3=0.0075(mol)
=>nOH{-}=0.0075*2=0.015(mol)
=>nOH{-}(tổng)=0.03+0.015=0.045(mol)
+nH2SO4=0.2x(mol)
=>nH{+}=0.2x*2=0.4x(mol)
_Sau phản ứng thu được dd có pH=2=>môi trường có tính axit.
+[H+] dư=10^-2M
_Vdd(sau)=300+200=500(ml)=0.5(lit)
=>nH{+} dư=10^-2*0.5=0.005(mol)
H{+}+OH{-}=>H2O
0.4x->0.045...........(mol)
0.045->0.045........(mol)
0.4x-0.045->0........(mol)
=>nH{+} dư=0.4x-0.045(mol)
<=>0.4x-0.045=0.005
<=>0.4x=0.05
<=>x=0.125M
Vậy [H2SO4]=0.125M
_Sau phản ứng thu được kết tủa BaSO4:
+nBa{2+}=nBa(OH)2=0.0075(mol)
+nSO4{2-}=0.2*0.125=0.025(mol)
Ba{2+}+SO4{2-}=>BaSO4
0.0075<0.025---->0.0075(mol)
=>mBaSO4=0.0075*233=1.7475(g) Tham khảo nha
+nNaOH=0.1*0.3=0.03(mol)=nOH{-}
+nBa(OH)2=0.025*0.3=0.0075(mol)
=>nOH{-}=0.0075*2=0.015(mol)
=>nOH{-}(tổng)=0.03+0.015=0.045(mol)
+nH2SO4=0.2x(mol)
=>nH{+}=0.2x*2=0.4x(mol)
_Sau phản ứng thu được dd có pH=2=>môi trường có tính axit.
+[H+] dư=10^-2M
_Vdd(sau)=300+200=500(ml)=0.5(lit)
=>nH{+} dư=10^-2*0.5=0.005(mol)
H{+}+OH{-}=>H2O
0.4x->0.045...........(mol)
0.045->0.045........(mol)
0.4x-0.045->0........(mol)
=>nH{+} dư=0.4x-0.045(mol)
<=>0.4x-0.045=0.005
<=>0.4x=0.05
<=>x=0.125M
Vậy [H2SO4]=0.125M
_Sau phản ứng thu được kết tủa BaSO4:
+nBa{2+}=nBa(OH)2=0.0075(mol)
+nSO4{2-}=0.2*0.125=0.025(mol)
Ba{2+}+SO4{2-}=>BaSO4
0.0075<0.025---->0.0075(mol)
=>mBaSO4=0.0075*233=1.7475(g)

Đáp án A
Dd C có: nHCO3-= 0,2 mol ; nCO32-= 0,2 mol.
Dd D:nH+= 0,3 mol ;
Nhỏ từ từ D vào C
CO32- + H+ → HCO3-
0,2 → 0,2 → 0,2
=> nH+ = 0,1 mol ; mol
Cho Ba(OH)2 vào E
HCO3- + H+ → H2O + CO2
0,1 → 0,1 → 0,1
=>VCO2= 0,1.22,4 = 2,24 lít.
Ba2+ + HCO3- + OH- → BaCO3 + H2O
0,3 → 0,3
Ba2+ + SO42- → BaSO4
0,1 → 0,1
=> m = 0,3.197 + 0,1.233 = 82,4 gam.

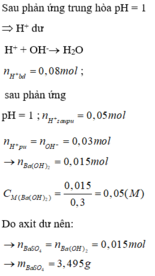

Đáp án C
nBa(OH)2 = 0,2.a mol; nOH-= 0,4a mol
dung dịch H2SO4 có pH = 1 nên [H+] = 10-1 M
→nH+ = [H+].Vdd = 0,3.10-1 = 0,03 mol, nSO4(2-) = 0,015 mol
H2SO4→ 2H++ SO42-
0,03 →0,015 mol
Ba(OH)2→ Ba2++ 2OH-
0,2a→ 0,2a 0,4a
H+ + OH- → H2O
0,4a 0,4a
Dung dịch sau phản ứng có pH = 2 nên axit dư
nH+ dư = 0,03-0,4a
[H+] dư = nH+ dư/ Vdd = (0,03-0,4a)/0,5 = 10-2 suy ra a = 0,0625 M
Ba2++ SO42- → BaSO4
0,0125 0,015 0,0125 mol
mBaSO4 = 2,9125 gam