Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D.
Ban đầu: nhỗn hợp= PV/RT= 56.200/0,082.273= 500 mol
→nN2=100 mol, nH2= 400 mol

Sau khi phản ứng xảy ra đưa về 00C thì áp suất trong bình giảm 10% so với áp suất ban đầu
→Số mol khí cũng giảm 10%
→nkhí sau pứ= 500- 10%.500= 450 mol
Mà nkhí sau pứ= (100-x)+ (400-3x)+2x= 450
→x=25 mol
→H= (x/100).100%=25%

Đáp án C.
N2+ 3H2 ⇌ 2NH3
Vì có  nên hiệu suất phản ứng tính theo N2 hoặc H2
nên hiệu suất phản ứng tính theo N2 hoặc H2
Giả sử ban đầu có 1 mol N2 và 3 mol H2, nkhí ban đầu= 4 mol
→nN2 pứ= 1.20%= 0,2 mol
N2+ 3H2 ⇌ 2NH3
Ban đầu 1 3 mol
Phản ứng 0,2 0,6 0,4 mol
Sau pứ 0,8 2,4 0,4 mol
nkhí sau pứ= 0,8 + 2,4 + 0,4= 3,6 mol
Trong cùng điều kiện nhiệt độ và thể tích thì tỉ lệ về số mol chính là tỉ lệ về áp suất


![]() Hỗn hợp anken hết trước, hiệu suất tính theo anken
Hỗn hợp anken hết trước, hiệu suất tính theo anken
Ta có: ![]() (vì n = pV/RT suy ra n tỉ lệ thuận với p)
(vì n = pV/RT suy ra n tỉ lệ thuận với p)
(trong đó n1, p1 là số mol và áp suất hỗn hợp lúc đầu, n2, p2 là số mol, áp suất hỗn hợp lúc sau)
![]()
Số mol hỗn hợp sau:
![]()
Số mol khí giảm
![]()
Vậy hiệu suất ![]()
Đáp án B.

Đáp án A
Đặt nC2H4 ban đầu = x mol; nH2 = y mol.
Ta có MY = 18 → H2 dư; hhY gồm C2H6 và H2 dư.
Theo BTKL: mX = mY = 28x + 2y gam.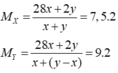
→ y = 5x → hhY gồm x mol C2H6 và 4x mol H2.
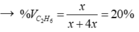

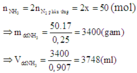
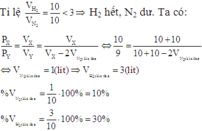

Đáp án A
N2 và H2 theo tỷ lệ thể tích là 1 : 4 tính hiệu suất theo N2