Hỗn hợp bột A gồm Fe và Mg có khối lượng 2.72g được chia làm hai phần bằng nhau:
Phần I: Cho vào 400ml dung dịch CuSO4 a(M). Cho dd NaOH dư vào dd C thu được kết tủa. Nung chất kết tủa trong kk đến khối lượng ko đổi cân đc 1,2g chất rắn D. Tính thành phần % theo khối lượng của mỗi kim loại trong hỗn hợp A và tính a ?
Phần II: Cho tác dụng với V ml dung dịch AgNO3 0,1 M. Sau khi phản ứng xong thu được chất rắn E có khối lượng 3,36g. Tính thành phần % theo khối lượng các chất trong chất rắn E. Tính thể tích của dung dịch AgNO3.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

khi cho Fe vào HCl tạo Fe2+
áp dụng định luật bảo toàn e ta có:
Fe => Fe2+ + 2e 2H+ +2e => H2
nFe = 0,05 mol => mFe=2,8 g => mFe2O3 =7,2g => nFe2O3=0,045 mol
nói chung khi nung kết tủa trong không khí đều tạo Fe2O3 => m (chất rắn)= 7,6 g

- Phần 1:
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\)
\(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_{2\downarrow}+Na_2SO_4\)
\(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
Ta có: \(n_{Fe_2O_3}=\dfrac{8}{160}=0,05\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{FeSO_4}=n_{Fe\left(OH\right)_2}=2n_{Fe_2O_3}=0,1\left(mol\right)\)\
- Phần 2:
\(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: \(n_{Al}=\dfrac{2}{3}n_{H_2}=0,1\left(mol\right)\)
%m trong 1 phần cũng là %m trong A.
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1.56}{0,1.56+0,1.27}.100\%\approx67,47\%\\\%m_{Al}\approx32,53\%\end{matrix}\right.\)

a) PTHH: \(Mg+CuSO_4\rightarrow MgSO_4+Cu\)
a_______a________a_____a (mol)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
b_______b_______b_____b (mol)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+Na_2SO_4\)
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+Na_2SO_4\)
\(Mg\left(OH\right)_2\xrightarrow[]{t^o}MgO+H_2O\)
\(4Fe\left(OH\right)_2+O_2\xrightarrow[]{t^o}2Fe_2O_3+4H_2O\)
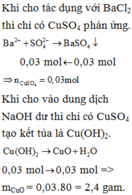
b) Ta có: \(n_{CuSO_4}=0,3\cdot1=0,3\left(mol\right)=n_{Cu}\)
\(\Rightarrow m_{Fe\left(dư\right)}=24,8-0,3\cdot64=5,6\left(g\right)\) \(\Rightarrow m_{Fe\left(p/ứ\right)}+m_{Mg}=16-5,6=10,4\left(g\right)\)
Ta lập hệ phương trình: \(\left\{{}\begin{matrix}24a+56b=10,4\\a+b=0,3\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,2\cdot24}{16}\cdot100\%=30\%\\\%m_{Fe}=70\%\end{matrix}\right.\)
c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{MgO}=n_{Mg}=0,2\left(mol\right)\\n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(p/ứ\right)}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{rắn}=m_{MgO}+m_{Fe_2O_3}=0,2\cdot40+0,05\cdot160=11\left(g\right)\)

Đáp án C
Sau phản ứng thu được hỗn hợp kim loại C => Chứng tỏ C chứa Ag, Cu, có thể có Fe dư, Al dư.
Có khối lượng chất rắn thu được ở phần 1 nhiều hơn phần 2 => Chứng tỏ trong dung dịch ngoài Al(NO3)3 còn chứa Fe(NO3)2
=> Al, Cu(NO3)2 và AgNO3 phản ứng hết, Fe có thể còn dư.
Đặt số mol Cu(NO3)2 và AgNO3 lần lượt là a, b.
Đặt số mol Al và Fe phản ứng lần lượt là x, ỵ
Chất rắn thu được ở phần 2 là Fe2O3 => 160.0,5y = 6,2 => y = 0,15
Chất rắn thu được ở phần 1 là Al2O3 và Fe2O3
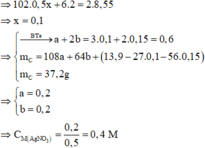



*) Xét phần I : \(m_{\left(Mg+Fe\right)}=2,72:2=1,36\left(g\right)\)
- Trường hợp 1 : Một nửa hỗn hợp A phản ứng hết với \(CuSO_4\)
Thứ tự phản ứng xảy ra :
\(Mg+CuSO_4\rightarrow MgSO_4+Cu\downarrow\)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\downarrow\)
=> Dung dịch C gồm có : \(FeSO_4,MgSO_4,CuSO_4\). Chất rắn B là Cu (có khối lượng là 1,84g).
Cho dung dịch C + dd NaOH \(\rightarrow\) kết tủa \(Fe\left(OH\right)_2,Mg\left(OH\right)_2,Cu\left(OH\right)_2\)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+Na_2SO_4\)
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+Na_2SO_4\)
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
Khi nung kết tủa :
\(Mg\left(OH\right)_2\rightarrow\left(t^0\right)MgO+H_2O\)
\(4Fe\left(OH\right)_2+O_2\rightarrow\left(t^0\right)2Fe_2O_3+4H_2O\)
\(Cu\left(OH\right)_2\rightarrow\left(t^0\right)CuO+H_2O\)
Oxit tương ứng sau khi nung trong không khí là \(Fe_2O_3,MgO,CuO\) có khối lượng là 1,2g < 1,36g, Vậy A chưa phản ứng hết.
- Trường hợp 2 : Một nửa hh A phản ứng chưa hết với \(CuSO_4\).
Giả thiết Mg pư chưa hết (mà Mg lại hoạt động hh mạnh hơn Fe) thì dung dịch \(CuSO_4\) phải hết và Fe chưa tham gia phản ứng.
\(\Rightarrow\) Dung dịch C là \(MgSO_4\) và chất rắn D chỉ có MgO.
\(Mg+CuSO_4\rightarrow MgSO_4+Cu\downarrow\)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+Na_2SO_4\)
\(Mg\left(OH\right)_2\rightarrow\left(t^0\right)MgO+H_2O\)
=> Số mol Mg phản ứng \(=n_{Cu}=n_{MgO}=1,2:40=0,03\left(mol\right)\)
Chất rắn B gồm Cu,Fe,Mg còn dư.
Nhưng ta thấy rằng \(m_{Cu-tạo-ra}=0,03\cdot64=1,92\left(g\right)>1,84\left(g\right)\), trái với điều kiện bài toán. Vậy Mg phải phản ứng hết và Fe tham gia một phần.
Như vậy :
Chất rắn B gồm có \(Cu,Fe\) còn dư.
Dung dịch C gồm có \(MgSO_4,FeSO_4\)
Chất rắn D gồm có MgO và \(Fe_2O_3\) có khối lượng là 1,2g.
Đặt x,y là số mol Fe, Mg trong \(\dfrac{1}{2}\) hỗn gợp A và số mol Fe dư là z.
Ta có : \(\left\{{}\begin{matrix}56x+24y=1,36\\\left(x-z\right)\cdot64+y\cdot64+56\cdot z=1,84\\160\cdot\left(x-z\right):2+40y=1,2\end{matrix}\right.\)
Giải hpt trên ta được x = 0,02 ; y = 0,01 ; z = 0,01.
Nên %Fe = 82,35% và %Mg = 17,65%.
Số mol của \(CuSO_4=0,02\left(mol\right)\)
=> \(a=\dfrac{0,02}{0,4}=0,05M\)
*) Xét phần 2 : Một nửa hỗn hợp A có khối lượng là 1,36g.
Độ tăng của khối lượng chất rắn = 3,36 - 1,36 = 2(g)
Giả thiết Fe chưa pư :
\(Mg+CuSO_4\rightarrow MgSO_4+Cu\downarrow\)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+Na_2SO_4\)
\(Mg\left(OH\right)_2\rightarrow\left(t^0\right)MgO+H_2O\)
Ta có số mol Mg phản ứng bằng :
\(2:\left(2\cdot108-24\right)=0,0104\left(mol\right)>n_{Mg}\) trong phần 1.
Như vậy Fe đã tham gia pư và Mg đã phản ứng hết.
\(m_{rắn-do-Mg-sinh-ra}=0,01\cdot\left(2\cdot108-24\right)=1,92\left(g\right)\)
\(m_{rắn-do-Fe-sinh-ra}=2-1,92=0,08\left(g\right)\)
\(n_{Fe-phản-ứng}=0,08:\left(2\cdot108-56\right)=0,0005\left(mol\right)\)
\(n_{Fe-dư}=0,02-0,0005=0,0195\left(mol\right)\)
Vậy chất rắn E gồm có Fe còn dư và Ag được sinh ra sau phản ứng.
\(m_{Fe}=0,0195\cdot56=1,092\left(g\right)\)
Nên \(\%Fe=\dfrac{1,092}{3,36}\cdot100\%=32,5\%\)
\(\%Ag=100\%-32,5\%=67,5\%\)
Tổng số mol \(AgNO_3\) đã phản ứng :
\(n_{AgNO_3}=\left(0,01+0,0005\right)\cdot2=0,021\left(mol\right)\)
Thể tích dung dịch \(AgNO_3\) đã dùng :
\(V_{dd}=\dfrac{0,021}{0,1}=0,21\left(l\right)\)
Bài này nếu 11h chưa ai giải thì mình sẽ giúp nhé, h đang đi đá banh :))