Đốt cháy hết 24,11g P có lẫn tạp chất trong oxi tinh khiết thu được 49,7g P205 .Xác định độ tinh khiết của P.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


# Cách thử độ tinh khiết của H2: Để tránh hiện tượng nổ mạnh, trước khi thử nghiệm người ta sẽ thử độ tinh khiết của H2H2 bằng cách thu H2 vào ống nghiệm nhỏ rồi đốt ở miệng ống nghiệm. Nếu H2 tinh khiết thì sẽ nghe tiếng nổ nhỏ, còn nếu H2 có lẫn không khí thì có tiếng nổ mạnh.

\(n_{CO_2}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PT: \(C+O_2\underrightarrow{t^o}CO_2\)
Theo PT: \(n_C=n_{CO_2}=0,8\left(mol\right)\)
\(\Rightarrow m_C=0,8.12=9,6\left(g\right)\)
Độ tinh khiết của mẫu C là: \(\dfrac{9,6}{15}.100\%=64\%\)

PTHH: 3Fe + 2O2 → Fe3O4
Số mol của Fe3O4 là: 23,2 : 232 = 0,1 (mol)
Số mol của Fe là: 0,1 . 3 = 0,3 (mol)
Khối lượng Fe nguyên chất tham gia phản ứng là:
0,3 . 56 = 16,8 gam
% tinh khiết của mẩu sắt là: (16,8:21).100% = 80%

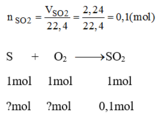
Theo pt: 1 mol S tham gia phản ứng sinh ra 1 mol S O 2
Số mol của lưu huỳnh tham gia phản ứng:
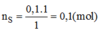
Khối lượng của lưu huỳnh tinh khiết: m S = n S . M S =0,1.32=3,2(g)
Độ tinh khiết của mẫu lưu huỳnh:
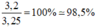

PTHH: 3Fe + 2O2 → Fe3O4
Số mol của Fe3O4 là: 23,2 : 232 = 0,1 (mol)
Số mol của Fe là: 0,1 . 3 = 0,3 (mol)
Khối lượng Fe nguyên chất tham gia phản ứng là:
0,3 . 56 = 16,8 gam
% tinh khiết của mẩu sắt là: (16,8:21).100% = 80%
Ta có PT:
3Fe + 2O2 ---> Fe3O4
n\(Fe_3O_4\)=\(\frac{23,2}{232}\)=0,1(mol)
Theo PT ta có:
nFe tinh khiết = 3n\(Fe_3O_4\)= 3.0,1=0,3(mol)
mFe tinh khiết = 0,3.56 = 16,8(g)
Độ tinh khiết của sắt đã dùng
= \(\frac{16,8}{21}\).100%=80%

\(PTHH:C+O_2\underrightarrow{t^o}CO_2\)
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Từ PTHH ta có
Đốt 1 mol C thì sinh ra 1 mol CO2
=> Đốt 0,3 mol C thì sinh ra 0,3 mol CO2
\(\Rightarrow m_C=0,3.12=3,6\left(g\right)\)
\(\Rightarrow\%C=\dfrac{3,6}{4}=90\%\)
Vậy độ tinh khiết của than là 90%



nP2O5 = \(\dfrac{49,7}{142}\)= 0.35 (mol)
4P + 5O2 -> 2 P2O5
4 : 5 : 2
0,7 < - 0,35 (mol)
mP = 0,7. 31 = 21,7 (g)
C%mP2O5 = \(\dfrac{21,7}{24,11}.100\%\)\(\approx\)90%