Cho 1,68g Fe tác dụng hết với dung dịch cuso4 dư tính khối lượng sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(\left\{{}\begin{matrix}m_{Fe}=1,68g;M_{Fe}=56g\\SốmolFe.n_{Fe}=\dfrac{n}{M}=\dfrac{1,68}{56}=0,03mol\end{matrix}\right.\)
Pt: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\downarrow\)
\(0,03mol\rightarrow0,03mol\)
\(\left\{{}\begin{matrix}n_{Cu\downarrow}=0,03mol;M_{Cu}=64\\\Rightarrow khốilượngCu.m_{Cu}=n.M=0,03.64=1,92\left(gam\right)\end{matrix}\right.\)
PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\downarrow\)
Ta có:\(n_{Fe}=\dfrac{1,68}{56}=0,03\left(mol\right)\)
=> \(n_{Cu}=n_{Fe}=0,3\left(mol\right)\\ \rightarrow m_{Cu}=0,3.64=19,2\left(g\right)\)

Đáp án A
Theo định luật bảo toàn mol electron, ta có:
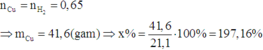
Với bài này, đề bài hỏi khối lượng chất rắn bằng bao nhiêu phần trăm so với khối lượng đầu.

Đáp án D
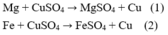
Nhận xét: khi cho bột kim loại vào dung dịch, khối lượng kim loại sau phản ứng sẽ tăng lên.
Ta có khoảng sau:
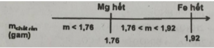


\(Mg>Fe\) => `Mg` phản ứng trước
\(Mg+Cu^{2+}\rightarrow Mg^{2+}+Cu^o\)
x----->x-------------------->x
\(Fe+Cu^{2+}\rightarrow Fe^{2+}+Cu^o\)
y----->y----------------->y
Giả sử nếu \(Cu^{2+}\) chuyển hết thành \(Cu^o\)
\(\Rightarrow n_{Cu^o}=n_{Cu^{2+}}=n_{kt}\)
Có \(n_{Cu^{2+}}=0,2.1=0,2\left(mol\right)\)
\(n_{kt}=\dfrac{15,6}{64}=0,24375\left(mol\right)>0,2\left(mol\right)\)
\(\Rightarrow\)Giả sử sai, kim loại Fe trong hỗn hợp X còn dư
Theo đề có: \(m_{Fe.dư}=m_{kt}-m_{Cu}=15,6-0,2.64=2,8\left(g\right)\)
Ta có hệ phương trình:
\(\left\{{}\begin{matrix}24x+56y=9,2-2,8=6,4\\x+y=0,2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,05\end{matrix}\right.\)
a. Trong X có:
\(\left\{{}\begin{matrix}m_{Mg}=24.0,15=3,6\left(g\right)\\m_{Fe}=56.0,05+2,8=5,6\left(g\right)\end{matrix}\right.\)
b
Y: \(\left\{{}\begin{matrix}n_{MgSO_4}=x=0,15\left(mol\right)\\n_{FeSO_4}=y=0,05\left(mol\right)\end{matrix}\right.\)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2+Na_2SO_4\)
0,15--------------------->0,15
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2+Na_2SO_4\)
0,05-------------------->0,05
\(m_{kt}=m_{Mg\left(OH\right)_2}+m_{Fe\left(OH\right)_2}=0,15.58+0,05.90=13,2\left(g\right)\)

Đặt \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Fe_2O_3}=y\left(mol\right)\end{matrix}\right.\Rightarrow56x+160y=4,8\left(1\right)\)
\(PTHH:Fe+CuSO_4\rightarrow FeSO_4+Cu\\ \Rightarrow n_{Cu}=n_{Fe}=a\left(mol\right)\\ Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\\ Cu+2FeCl_3\rightarrow CuCl_2+2FeCl_2\\ \Rightarrow n_{Cu}=\dfrac{1}{2}n_{FeCl_3}=n_{Fe_2O_3}=b\left(mol\right)\\ \Rightarrow n_{Cu\left(dư\right)}=a-b=\dfrac{3,2}{64}=0,05\left(mol\right)\left(2\right)\)
\(\left(1\right)\left(2\right)\Rightarrow\left\{{}\begin{matrix}a=\dfrac{8}{135}\\b=\dfrac{1}{108}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}\%_{Fe}=\left(\dfrac{8}{135}\cdot56\right):4,8\cdot100\%\approx69,14\%\\\%_{Fe_2O_3}\approx30,86\%\end{matrix}\right.\)
\(b,n_{HCl}=6n_{Fe_2O_3}=\dfrac{1}{18}\approx0,06\left(mol\right)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,06}{1}=0,06\left(l\right)\)

\(n_{Fe}=\frac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=\frac{250}{1000}.0,7=0,175\left(mol\right)\)
PTHH : Fe + 2HCl -----> FeCl2 + H2
(mol) 0,1 0,175 0,1
Ta có : \(\frac{n_{Fe}\left(\text{phản ứng}\right)}{n_{Fe}\left(\text{phương trình}\right)}=\frac{0,1}{1}>\frac{n_{HCl}\left(\text{phản ứng}\right)}{n_{HCl}\left(\text{phương trình}\right)}=\frac{0,175}{2}\)
Suy ra HCl phản ứng hết , Fe dư 0,1 - 0,175/2 = 0,0125(mol)
Fe + 2HCl ----> FeCl2 + H2
tính nFe =0,1 ; nHCl = 0,175
từ pt => Fe dư , HCl hết , nFe dư = 0,1 - 0,175/2=0,0125 mol
dd sau pu gồm Fe dư = 0,0125 , FeCl2= 0,175/2 = 0,0875 > CM = n/V ;
H2 + CuO ---> Cu + H2O
nH2 = 0,0875 ; nCuO = 0,2 , từ pt => CuO dư = 0,2 - 0,0875 = 0,1125 và Cu tạo thành = 0,0875 => khối lượng từng chất

Bài 4:
4Na + O2 → 2Na2O
nNa = \(\dfrac{4,6}{23}\)= 0,2 mol , nO2 = \(\dfrac{2,24}{22,4}\)= 0,1 mol
\(\dfrac{nNa}{4}\)<\(\dfrac{nO_2}{1}\)=> Sau phản ứng oxi dư , nO2 phản ứng = \(\dfrac{nNa}{4}\)= 0,05 mol
=> nO2 dư = 0,1 - 0,05 = 0,05 mol <=> mO2 dư = 0,05.32= 1,6 gam
a) nNa2O = 1/2 nNa = 0,1 mol
=> mNa2O = 0,1. 62 = 6,2 gam
Bài 1:
Zn + 2HCl → ZnCl2 + H2
a) nZn = \(\dfrac{6,5}{65}\)= 0,1 mol , nHCl = \(\dfrac{3,65}{36,5}\)= 0,1 mol
Ta có \(\dfrac{nZn}{1}\)> \(\dfrac{nHCl}{2}\)=> Zn dư , HCl phản ứng hết
nZnCl2 = \(\dfrac{nHCl}{2}\)= 0,5 mol => mZnCl2 = 0,5. 136 = 68 gam
b) nH2 = \(\dfrac{nHCl}{2}\) = 0,5 mol => V H2 = 0,5.22,4 = 11,2 lít


Fe + CuSO4 -> FeSO4 + Cu
nFe=0,03(mol)
Theo PTHH ta có:
nFeSO4=nCu=nFe=0,03(mol)
mFeSO4=152.0,03=4,56(g)
mCu=64.0,03=1,92(g)
khối lượng gi bạn