Nén một hỗn hợp khí gồm 2,0 mol nitơ và 7,0 mol hiđro trong một bình phản ứng có sẵn chất xúc tác thích hợp và nhiệt độ của bình được giữ không đổi ở 450 ° C . Sau phản ứng thu được 8,2 mol một hỗn hợp khí.
1. Tính phần trăm số mol nitơ đã phản ứng.
2. Tính thể tích (đktc) khí amoniac được tạo thành.


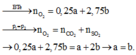
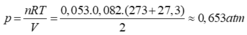
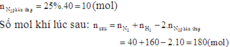

N 2 (k) + 3 H 2 (k) ↔ 2 N H 3 (k)
Số mol khí ban đầu :
2 7 0
Số mol khí đã phản ứng :
x 3x
Số mol khí lúc cần bằng :
2 - x 7 - 3x 2x
Tổng số mol khí lúc cân bằng : (2 - x) + (7 - 3x) + 2x = 9 - 2x
Theo đề bài : 9 - 2x = 8,2 ⇔ x = 0,4
1. Phần trăm sô mol nitơ đã phản ứng: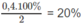
2. Thể tích (đktc) khí amoniac được tạo thành: 2.0,4.22,4 = 17,9 (lít).