Dung dịch X có chứa: 0,07 mol Na+, 0,02 mol SO42- và x mol OH-. Dung dịch Y có chứa ClO4-, NO3- và y mol H+; tổng số mol ClO4- và NO3- là 0,04. Trộn X và Y được 100ml dung dịch Z. Dung dịch Z có pH (bỏ qua sự điện li của nước) là:
A. 1.
B. 12.
C. 13.
D. 2.


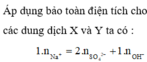




Đáp án A
Theo ĐL BT ĐT thì x = 0,03 mol
Theo ĐLBT ĐT thì nH+ = nClO4(-)+ nNO3(-) = 0,04 mol
H+ + OH- → H2O
0,04 0,03
nH+ dư = 0,01 mol; [H+] dư = 0,01/0,1 = 0,1 suy ra pH = 1