Hỗn hợp X chứa 0,2 mol Al; 0,04 mol FeO; 0,05 mol Fe2O3, 0,08 mol CuO và 0,06 mol Fe3O4. Người ta cho X vào ống sứ (không có không khí) rồi nung nóng một thời gian thu được hỗn hợp Y (có chứa 3,84 gam Cu). Tách toàn bộ lượng Cu có trong Y ra ta được hỗn hợp rắn Z. Cho Z tác dụng với lượng vừa đủ HCl thấy thoát ra 3,36 lít khí H2 (đktc) và dung dịch T. Cho AgNO3 dư vào dung dịch T thu được m gam hỗn hợp kết tủa. Giá trị của m là:
A. 156,48
B. 219,66
C. 182,46
D. 169,93




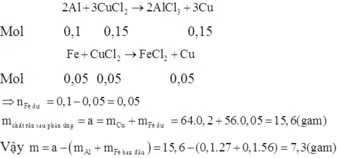

Chọn đáp án B.