Cho 10,5 gam hỗn hợp hai kim loại Cu và Zn vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (ở đktc). Thành phần phần trăm của hỗn hợp kim loại là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn B
Chỉ có Zn phản ứng với H 2 S O 4 , Cu không phản ứng


- Cu không tác dụng được với dd H2SO4 loãng.
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ n_{Zn}=n_{H_2}=0,1\left(mol\right)\\ \Rightarrow\%m_{Zn}=\dfrac{0,1.65}{10,5}.100\approx61,905\%\\ \Rightarrow\%m_{Cu}\approx38,095\%\)
anh giúp em bài này với https://hoc24.vn/cau-hoi/giup-minh-voi-trong-tam-giai-thich-ki-cai-de-nha-cam-on.2017646398420

$Zn + H_2SO_4 \to ZnSO_4 + H_2$
Theo PTHH :
$n_{Zn} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)$
$\%m_{Zn} = \dfrac{0,1.65}{10,5}.100\% = 61,9\%$
Chọn đáp án A

a. PTHH:
\(Zn+H_2SO_4--->ZnSO_4+H_2\)
\(Cu+H_2SO_4--\times-->\)
b. Theo PT: \(n_{Zn}=n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(\Rightarrow m_{_{ }Zn}=0,1.65=6,5\left(g\right)\)
\(\Rightarrow\%_{m_{Zn}}=\dfrac{6,5}{10,5}.100\%=61,9\%\)
\(\%_{m_{Cu}}=100\%-61,9\%=31,8\%\)
\(Zn + H_2SO_4 \rightarrow ZnSO_4 + H_2\)
Cu không phản ứng H2SO4 loãng nhé
\(n_{H_2}= \dfrac{2,24}{22,4}= 0,1 mol\)
Theo PTHH:
\(n_{Zn}=n_{H_2}= 0,1 mol\)
\(\Rightarrow m_{Zn}= 0,1 . 65= 6,5 g\)
\(\Rightarrow\)%mZn=\(\dfrac{6,5}{10,5} . 100\)%~ 61,9%
\(\Rightarrow\)%mCu= 100% - 61,9%=38,1 %

\(a.Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ b.n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ n_{Zn}=n_{H_2}=0,1\left(mol\right)\\ \Rightarrow\%m_{Zn}=\dfrac{0,1.65}{10,5}.100=61,9\%\\ \%m_{Cu}=100-61,9=38,1\%\)

Zn+ H2SO4→ ZnSO4+ H2↑
(mol) 0,1 0,1 0,1
a)
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{2,24}{22,4}=0,1\left(lít\right)\)
→mZn=n.M=0,1.65= 6,5(g)
→mCu= 10- 6,5= 3,5(g)
=> \(\%m_{Zn}=\dfrac{6,5}{10}.100\%=65\%\)
\(\%m_{Cu}=100\%-65\%=35\%\)
b) \(C_{M_{H_2SO_4}}=\dfrac{n}{V}=\dfrac{0,1}{0,1}=1M\)

a. PTHH:
\(Zn+H_2SO_4--->ZnSO_4+H_2\uparrow\)
\(Cu+H_2SO_4--\times-->\)
b. Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2SO_4}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,1}{\dfrac{200}{1000}}=0,5M\)
c. Ta có: \(m_{Zn}=0,1.65=6,5\left(g\right)\)
\(\Rightarrow m_{Cu}=10,5-6,5=4\left(g\right)\)

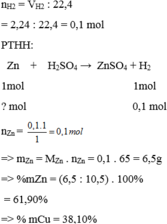

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
_____0,1<-------------------------0,1
=> mZn = 0,1.65 = 6,5 (g)
\(\left\{{}\begin{matrix}\%Zn=\dfrac{6,5}{10,5}.100\%=61,9\%\\\%Cu=\dfrac{10,5-6,5}{10,5}.100\%=38,1\%\end{matrix}\right.\)