nung nóng hỗn hợp gồm 16,8 gam fe và 6,4 gam S (trong điều kiện không có oxi) thu được hỗn hợp X. hòa tan X trong dung dịch hcl dư thu được V lít hỗn hợp khí Y đktc. Biết các phản ứng xảy ra hoàn toàn
a, viết Phương trình phản ứng xảy ra
b, tính giá trị của V


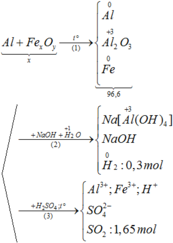
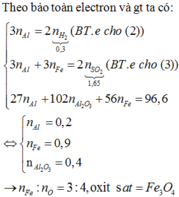
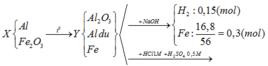
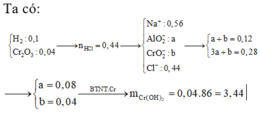
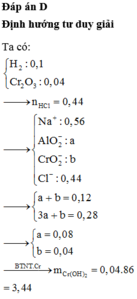
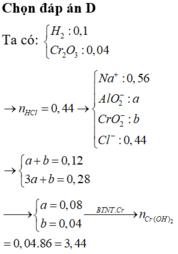


\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(n_S=\dfrac{6,4}{32}=0,2mol\)
\(Fe+S\rightarrow FeS\)
0,3 0,2 0,2
Sau phản ứng Fe dư và dư 0,1mol.
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
0,2 0,2
\(Fe_{dư}+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,1 0,1
\(\Sigma n_{khí}=0,2+0,1=0,3mol\)
\(\Rightarrow V_{khí}=0,3\cdot22,4=6,72l\)