Cho a gam dd H2SO4 loãng nồng độ C% tác dụng với một lượng hh hai kim loại Na và Mg ( dùng dư ) thì khối lượng H2 tạo thành là 0,05a gam. Tính C
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(2Na+H_2SO_4\rightarrow Na_2SO_4+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(nH_2=\dfrac{0,05}{2}=0,025\left(mol\right)\)
=>\(nH_2SO_4=0,025\left(mol\right)\)
=> \(mH_2SO_4=0,025.98=2,45\left(g\right)\)
- muốn tính C% H2SO4 cần thêm dữ kiện .

Gọi mol của Mg và Al là x, y mol
=> 24x + 27y = 12,6 (1)
nH2 = 0,6 mol => x + 1,5y = 0,6 (2)
Từ (1) (2) => x = 0,3 ; y = 0,2
=> %Mg = 57,14%
=> %Al = 42,86%

\(n_{H_2} = \dfrac{0,05a}{2} = 0,025a(mol)\\ n_{HCl} = \dfrac{a.C\%}{36,5} = \dfrac{a.C}{3650}(mol)\\ n_{H_2O} = \dfrac{a-a.C\%}{18}(mol)\)
\(Na + HCl \to NaCl + \dfrac{1}{2}H_2\\ K + HCl \to KCl + \dfrac{1}{2}H_2\\ Na + H_2O \to NaOH + \dfrac{1}{2}H_2\\ K + H_2O \to KOH + \dfrac{1}{2}H_2\\ 2n_{H_2} = n_{HCl} + n_{H_2O}\\ \Rightarrow 0,025a.2 = \dfrac{a.C}{3650} + \dfrac{a-a.C\%}{18}\)
\(\Leftrightarrow 0,05 = \dfrac{C}{3650} + \dfrac{1-0,01C}{18}\\ \Rightarrow C = 19,72\)

Vì Na dư nên nó sẽ phản ứng với cả H2O nữa
Coi lượng axit phản ứng là 100 g dd H2SO4 x % => mH2SO4 =x g
H2SO4 --> 2x/98 g H2
Na + H2O --> NaOH + 1/2H2
100-x (100-x)/18
=> 2x/98 + (100-x)/18 = 5 => x=15,8 => C% H2SO4 là 15,8 %
Mg và Na cũng tạo khí vs H2SO4 mà sao chỉ tính mỗi Na dư tạo khí vs H2O vậy.

Đáp án B
Chọn m = 100 (gam). Vì kim loại dùng dư nên sau khi axit hết, K tác dụng với nước cũng sinh H2.
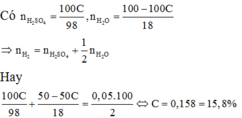

Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
Mg + H2SO4 ---> MgSO4 + H2
a---------------------------------->a
Zn + H2SO4 ---> ZnSO4 + H2
b---------------------------------->b
\(\Rightarrow\left\{{}\begin{matrix}24a+65b=8,9\\a+b=\dfrac{4,48}{22,4}=0,2\end{matrix}\right.\Leftrightarrow a=b=0,1\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}m_{Mg}=0,1.24=2,4\left(g\right)\\m_{Zn}=0,1.65=6,5\left(g\right)\end{matrix}\right.\)

A.Mg + H2SO4 --> MgSO4 + H2
Cu + H2SO4 -×->(không pư)
B. nH2 = 2,24/22,4 = 0,1(mol)
nMg = nH2 = 0,1mol
mMg = 0,1.24 = 2,4 (g)
mCu = 10 - 2,4 = 7,6(g)
C. %Mg = 2,4/10 ×100 = 24%
%Cu = 100 - 24 = 76%

\(n_{H_2}=\dfrac{2,464}{22,4}=0,11mol\)
\(\left\{{}\begin{matrix}Al:x\left(mol\right)\\Fe:y\left(mol\right)\end{matrix}\right.\Rightarrow Muối\left\{{}\begin{matrix}Al_2\left(SO_4\right)_3\\FeSO_4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}BTe:3x+2y=2n_{H_2}=0,22\\\dfrac{x}{2}\cdot342+y\cdot152=14,44\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,04mol\\y=0,05mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,04\cdot27=1,08g\\m_{Fe}=0,05\cdot56=2,8g\end{matrix}\right.\)
\(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow2AlCl_3+3BaSO_4\downarrow\)
0,02 0,06
\(FeSO_4+BaCl_2\rightarrow BaSO_4\downarrow+FeCl_2\)
0,05 0,05
\(\Rightarrow\Sigma n_{\downarrow}=0,06+0,05=0,11\Rightarrow m_{BaSO_4}=x=25,63g\)



$m_{H_2SO_4} = a.C\%(gam) \Rightarrow n_{H_2SO_4} = \dfrac{a.C\%}{98}$
$m_{H_2O\ trong\ dd\ axit} = a - a.C\% \Rightarrow n_{H_2O} = \dfrac{a - a.C\%}{18}$
$2Na + H_2SO_4 \to Na_2SO_4 + H_2$
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$2Na + 2H_2O \to 2NaOH + H_2$
Theo PTHH :
$n_{H_2} = n_{H_2SO_4} + \dfrac{1}{2}n_{H_2O}$
$\Rightarrow \dfrac{0,05a}{2} = \dfrac{a.C\%}{98} + \dfrac{1}{2}.\dfrac{a - a.C\%}{18}$
$\Rightarrow C\% = 0,158 = 15,8\%$