Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2-->0,4----->0,2--->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
b) mHCl = 0,4.36,5 = 14,6 (g)
=> \(m_{dd.HCl}=\dfrac{14,6.100}{7,3}=200\left(g\right)\)
c)
mdd sau pư = 13 + 200 - 0,2.2 = 212,6 (g)
mZnCl2 = 0,2.136 = 27,2 (g)
=> \(C\%=\dfrac{27,2}{212,6}.100\%=12,8\%\)

a) n Fe = 28/56 = 0,5(mol)
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH :
n HCl = 2n Fe = 1(mol)
=> m dd HCl = 1.36,5/10% = 365(gam)
b)
n FeCl2 = n H2 = n Fe = 0,5(mol)
Suy ra :
V H2 = 0,5.22,4 = 11,2(lít)
m FeCl2 = 0,5.127 = 63,5(gam)
c)
Sau phản ứng:
mdd = m Fe + mdd HCl - m H2 = 28 + 365 - 0,5.2 = 392(gam)
=> C% FeCl2 = 63,5/392 .100% = 16,2%

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow m_{ZnCl_2}=0,2.136=27,2\left(g\right)\)
d, \(n_{HCl}=2n_{Zn}=0,4\left(mol\right)\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{14,6}{7,3\%}=200\left(g\right)\)
⇒ m dd sau pư = 13 + 200 - 0,2.2 = 212,6 (g)
\(\Rightarrow C\%_{ZnCl_2}=\dfrac{27,2}{212,6}.100\%\approx12,79\%\)

1. Gọi mol của Mg và Al là x, y mol
=> 24x + 27y = 12,6 (1)
nH2 = 0,6 mol => x + 1,5y = 0,6 (2)
Từ (1) (2) => x = 0,3 ; y = 0,2
=> %Mg = 57,14%
=> %Al = 42,86%
nH2=13,44/22,4=0,6(mol)
Đặt: nMg=a(mol); nAl=b(mol) (a,b>0)
1) PTHH: Mg + H2SO4 -> MgSO4 + H2
a__________a________a_____a(mol)
2Al +3 H2SO4 -> Al2(SO4)3 + 3 H2
b___1,5b______0,5b____1,5b(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}24a+27b=12,6\\a+1,5b=0,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
=> mMg=0,3.24=7,2(g)
=>%mMg= (7,2/12,6).100=57,143%
=>%mAl=42,857%
2) mMgSO4=120.a=120.0,3=36(g)
mAl2(SO4)3=342.0,5b=342.0,5.0,2= 34,2(g)
mH2SO4= (0,3+0,2.1,5).98=58,8(g)
=>mddH2SO4=58,8: 14,7%=400(g)
=>mddsau= 12,6+400 - 2.0,6= 411,4(g)
=>C%ddAl2(SO4)3= (34,2/411,4).100=8,313%
C%ddMgSO4=(36/411,4).100=8,751%

1 ) CAO +H2O => CA(OH)2 (1)
2K + 2H2O => 2KOH + H2(2)
n (H2) =1,12/22,4 =0,05
theo ptpư 2 : n(K) = 2n (h2) =2.0.05=0,1(mol)
=> m (K) =39.0,1=3,9 (g)
% K= 3,9/9,5 .100% =41,05%
%ca =100%-41,05%=58,95%
xo + 2hcl =>xcl2 +h2o
10,4/X+16 15,9/x+71
=> giải ra tìm đc X bằng bao nhiêu thì ra

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Zn}=0,4\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,4}{0,2}=2\left(M\right)\)
b, Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{0,224}{22,4}=0,01\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,01}{1}\), ta được H2 dư.
Theo PT: \(n_{H_2\left(pư\right)}=2n_{O_2}=0,02\left(mol\right)\)
\(\Rightarrow n_{H_2\left(dư\right)}=0,18\left(mol\right)\Rightarrow V_{H_2\left(dư\right)}=0,18.22,4=4,032\left(l\right)\)
A) Ta sử dụng phương trình cân bằ để tính số mol của Zn:
Zn + 2HCI -> ZnCl2 + H2
Theo đó, số mol Zn = số mol HCI C
dùng
Mặt khác, theo đề bài, ta biết số ga
Zn là 13g. Từ khối lượng và khối
lượng riêng của Zn, ta tính được s
mol Zn:
n(Zn) = m(Zn) / M(Zn) = 13/65.38
0.199 mol
Vậy số mol HCl đã dùng cũng bằn
0.199 mol.
Nồng độ mol của dung dịch HCl đã dùng:
C(HCI)= n(HCI) / V(HCI) = 0.199 / 0.2
= 0.995 M
Theo phương trình phản ứng, 1 mol Zn sinh ra 1 mol H2. Vậy số mol H2 sinh ra trong phản ứng là 0.199 mol.
Theo định luật Avogadro, 1 mol khí ở điều kiện tiêu chuẩn (ĐKTC) chiếm thể tích là 22.4 lít. Vậy thể tích của 0.199 mol H2 ở ĐKTC là:
V(H2) = n(H2) x 22.4 = 0.199 x 22.4 = 4.45 lít
Do đó, khí O2 đã phản ứng với H2 để tạo ra nước. Theo phương trình phản ứng, ta biết tỉ lệ mol giữa O2 và H2 là 1:2. Vậy số mol O2 đã phản ứng là 0.199/20.0995 mol.
Từ đó, ta tính được khối lượng của O2 đã phản ứng:
m(O2) = n(O2) x M(O2) = 0.0995 x 32
Vậy chất còn dư sau phản ứng là O2, thể tích của O2 còn dư là:
V(O2) = m(02) x (1/V(Mol)) x (V(DKTC)/P) = 3.184 x (1/32) x (273/1) / (1.01 x 10^5) = 0.083 lít (lít ở ĐKTC)

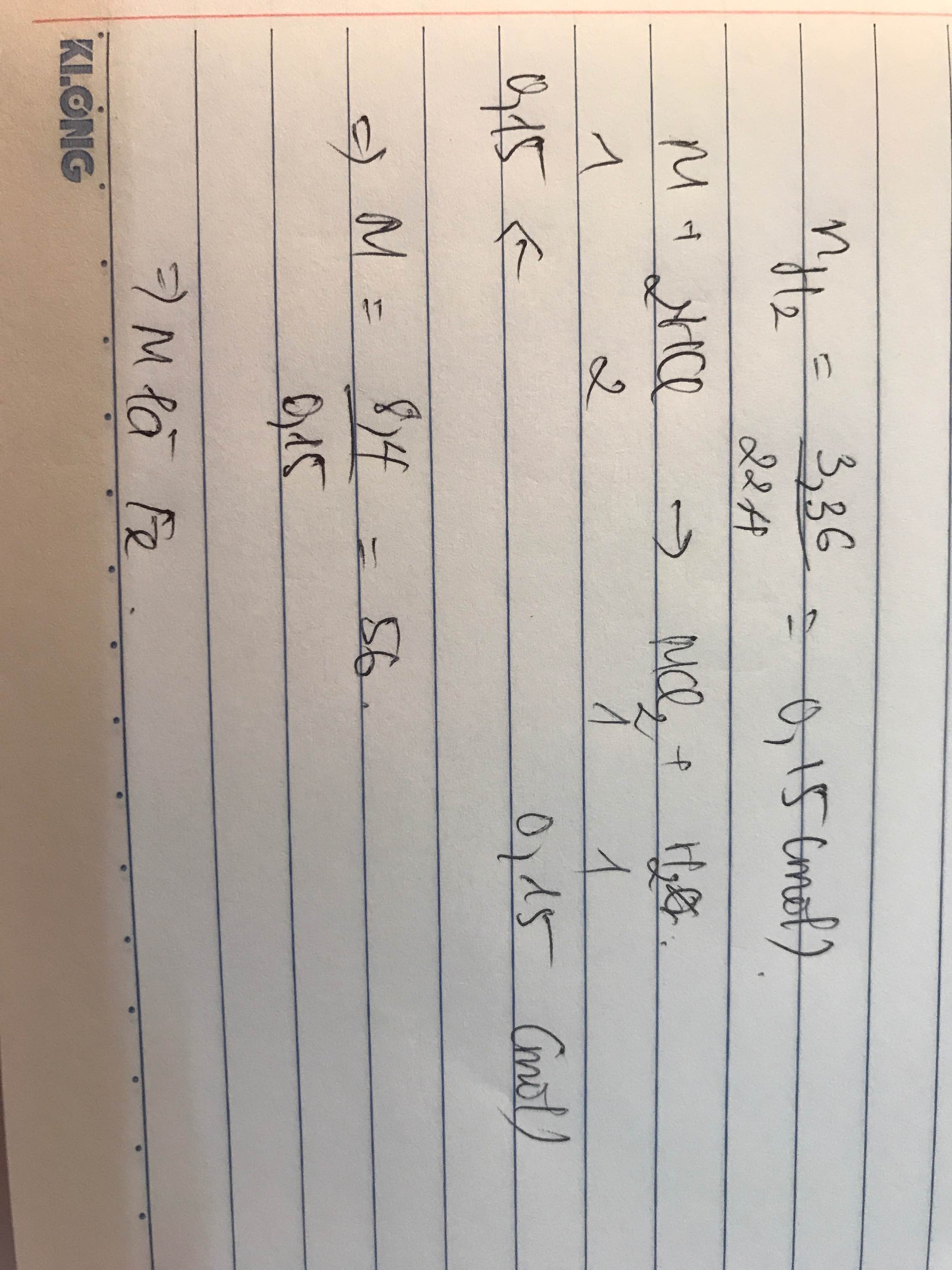

bài 1: nZn= 0,5 mol
Zn + 2HCl → ZnCl2 + H2↑
0,5 mol 1 mol 0,5 mol 0,5 mol
a) mHCl= 36,5 (g) → mdung dịch HCl 10% = 36,5 / 10%= 365 (g)
b) mZnCl2= 0,5x 136= 68 (g)
c) mdung dịch= mZn + mdung dịch HCl 10% - mH2= 32,5 + 365 - 0,5x2 = 396,5 (g)
→ C%ZnCl2= 68/396,5 x100%= 17,15%
Bài 2: Cách phân biệt:
Dùng quỳ tím:→ lọ nào làm quỳ chuyển thành màu đỏ: HCl và H2SO4 (cặp I)
→ quỳ không đổi màu: BaCl2 và NaCl ( cặp II)
→ quỳ chuyển màu xanh: NaOH và Ba(OH)2 ( cặp III)
Đối với cặp I: ta cho dung dịch BaCl2 vào, ống có kết tủa trắng chính là ống đựng H2SO4, ống còn lại chứa dung dịch HCl
Đối với cặp II: ta cho dung dịch H2SO4 vào, ống có kết tủa trắng chính là ống đựng BaCl2, ống còn lại là NaCl
Đối với cặp III: ta cho dung dịch H2SO4 vào, ống có kết tủa trắng chính là ống đựng Ba(OH)2, ống còn lại là NaOH
PTPU: BaCl2 + H2SO4→ BaSO4↓ + 2HCl
Ba(OH)2 + H2SO4→ BaSO4↓ + 2H2O