Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

đáp án D
Ta có mKhí = mMg – mdd tăng = 0,56 gam
⇒ MKhí = 0,56 ÷ 0,02 = 28 ⇒ X là khí N2.
Bảo toàn e có nNH4NO3 = (2nMg – 10nN2) ÷ 8 = 0,0125
+ Nhận thấy cuối cùng Na sẽ đi về muối NaNO3 ⇒ Tìm ∑nNO3 có trong dung dịch Y.
Bảo toàn nito ta có nNO3/Y = nHNO3 – 2nN2 – nNH4 = 0,3475 mol.
⇒ nNaOH = 0,3475 mol ⇒ VNaOH = 0,17375 lít = 175,75 ml ⇒ Chọn D

Đáp án A
nZn=0,66 mol => nZn(NO3)2=0,66 mol => mNH4NO3=129,54-0,66.189=4,8 gam => nNH4NO3=0,06 mol
G/s: NO: x mol; N2O=y mol
x+y=4,032/22,4=0,18
3x+2y.4+8.0,06=0,66.2 (BT e)
=> x=0,12; y=0,06
BTNT N: nHNO3=2nZn(NO3)2+nNO+2nN2O+2nNH4NO3=2.0,66+0,12+2.0,06+2.0,06=1,68 mol
V=mdd/d=[mHNO3.100/C]/d=(1,68.63.100/10)/1,26=840 ml

$n_{Al(NO_3)_3} = n_{Al} = 0,11(mol)$
$\Rightarrow n_{NH_4NO_3} = \dfrac{25,83 - 0,11.213}{80} = 0,03(mol)$
Bảo toàn electron :$3n_{Al} = 8n_{NH_4NO_3} + 3n_{NO}$
$\Rightarrow n_{NO} = 0,03(mol)$
$V = 0,03.22,4 = 0,672(lít)$
$n_{HNO_3} = 10n_{NH_4NO_3} + 4n_{NO} = 0,42 \Rightarrow x = 0,42 : 2 = 0,21$
$C_{M_{Al(NO_3)_3}} = \dfrac{0,11}{0,21} = 0,52M$
$C_{M_{NH_4NO_3}} = \dfrac{0,03}{0,21} = 0,1428M$

Ta có: nAl= 0,18 mol= nAl(NO3)3; nNO= 0,1 mol
QT cho e :
Al→ Al3++ 3e (1)
0,18 0,54 mol
QT nhận e :
N+5+ 3e → NO (2)
0,3 0,1
Nếu chỉ có quá trình nhận e (2) thì số mol e cho khác số mol e nhận
Do đó phải có quá trình :
NO3-+ 8e+ 10H+ → NH4+ + 3H2O (3)
0,24→ 0,03
Theo ĐL BT e : ne cho= ne nhận nên 0,54= 0,3+ ne nhận ở quá trình 3
→ ne nhận ở quá trình 3= 0,24 mol
Muối khan thu được có Al(NO3)3 : 0,18 mol; NH4NO3: 0,03 mol
→m=0,18. 213 + 0,03.80=40,74 gam
Đáp án A

Gọi n Mg = a; n Zn = b ⇒ 24a + 27b = 8,9g (1)
nHNO3 ban đầu = 0,5
nN2O = 0,045
Gọi số mol muối NH4NO3 là x mol
Bảo toàn e ta có: 2nMg + 2nZn = 8nN2O + 8nNH4NO3
⇒ 2a + 2b – 8x = 0,36 (2)
Bảo toàn nguyên tố N ta có:
n HNO3 = n NO3- trong muối KL + 2n NH4NO3 + 2n N2O
⇒10n N2O + 10n NH4NO3 = 0,5 mol ( n NO3- trong muối KL = n e = 8n NH4NO3 + 8n N2O)
⇒ n NH4NO3 = 0,005 (mol)
⇒ n NO3- trong muối KL = 0,4 mol
mmuối = mNO3-/muối KL + mKL + mNH4NO3 = 0,4.62 + 8,9 + 0,005.80 = 34,1
Đáp án B.

Quy đổi hỗn hợp Fe(a), O(b)
->56a+16b=17.2
mmuối =56a+62(2b+0,1.3)=57.4
->a=0.25,b=0.2
Dễ thấy 2a<2b+0,1.3<3a nên muối chưa Fe 2+ và Fe3+
->HNO3 hết
BT e: 2a+2nCu=2b+0,1.3
->nCu=0,1

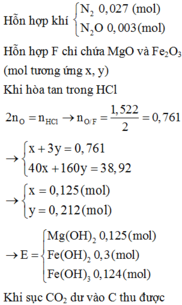

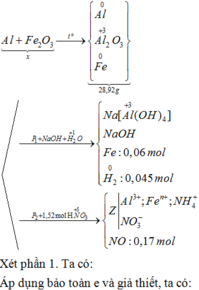
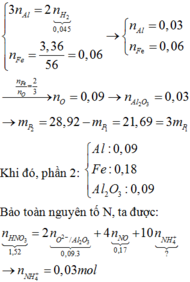
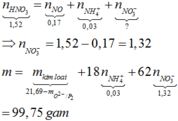

Ta có nAl= 0,18 mol= nAl(NO3)3, nNaOH= 0,75 mol
Dung dịch X chứa Al(NO3)3, có thể có NH4NO3
Al3++ 3OH-→ Al(OH)3↓ (1)
0,18 0,54 0,18
Al(OH)3+ OH- → AlO2-+ 2H2O (2)
0,18 0,18
Tổng mol OH- ở (1) và (2) là nOH-= 0,54+ 0,18= 0,72 mol < 0,75 mol
Nên có PT (3) với nOH- PT3= 0,75- 0,72= 0,03 mol
NH4++ OH- → NH3+ H2O (3)
0,03 0,03 mol
QT cho e:
Al → Al3++ 3e (1)
0,18 0,54
QT nhận e:
NO3-+ 8e+ 10H+ → NH4++ 3H2O (2)
0,24 ← 0, 03 mol
NO3-+ 3e+ 4H+ → NO+ 2H2O (3)
Theo ĐL bảo toàn e: ne cho= ne nhận nên 0,54=8.nNH4++ 3.nNO
Hay 0,54=8. 0,03+ 3.nNO suy ra nNO= 0,1 mol → V= 2,24 lít
Đáp án D