Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nO2 = 11,2/22,4 = 0,5 (mol)
PTHH: 2KClO3 -> (t°, MnO2) 2KCl + 3O2
Mol: 1/3 <--- 1/3 <--- 0,5
nKClO3 (ban đầu) = 61,25/122,5 = 0,5 (mol)
H = (1/3)/0,5 = 66,66%

a.\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
2 2 3 ( mol )
0,1 0,15
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)
b.\(V_{kk}=V_{O_2}.5=3,36.5=16,8l\)
c.\(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{28}{56}=0,5mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
3 2 1 ( mol )
0,5 > 0,15 ( mol )
0,225 0,15 ( mol )
\(m_{Fe\left(du\right)}=n_{Fe\left(du\right)}.M_{Fe}=\left(0,5-0,225\right).56=15,4g\)

Câu 3.
a.b.\(n_{KClO_3}=\dfrac{24,5}{122,5}=0,2mol\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,2 0,3 ( mol )
\(V_{O_2}=0,3.22,4=6,72l\)
c.\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,2 < 0,3 ( mol )
0,2 0,1 ( mol )
\(m_{Al_2O_3}=0,1.102=10,2g\)
Câu 4.
a.b.
\(n_{KClO_3}=\dfrac{12,25}{122,5}=0,1mol\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,1 0,15 ( mol )
\(V_{O_2}=0,15.22,4=3,36l\)
c.\(n_{Fe}=\dfrac{8,4}{56}=0,15mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,15 < 0,15 ( mol )
0,15 0,05 ( mol )
\(m_{Fe_3O_4}=0,05.232=11,6g\)

\(m_S=0,5\%.24=0,12\left(kg\right)=120\left(g\right)\\ \Rightarrow n_S=\dfrac{120}{32}=3,75\left(mol\right)\\ m_C=1,5\%.24=0,36\left(kg\right)=360\left(g\right)\\ \Rightarrow n_C=\dfrac{360}{12}=30\left(mol\right)\\ S+O_2\rightarrow\left(t^o\right)SO_2\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ n_{SO_2}=n_S=3,75\left(mol\right)\\ \Rightarrow V_{SO_2\left(đktc\right)}=3,75.22,4=84\left(l\right)\\ n_{CO_2}=n_C=30\left(mol\right)\\ \Rightarrow V_{CO_2\left(đktc\right)}=22,4.30=672\left(l\right)\)
(Chắc đề là 1,5% C)

Bài 1:
a, \(S+O_2\underrightarrow{t^o}SO_2\)
b, Ta có: \(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\)
Theo PT: \(n_{SO_2}=n_S=0,1\left(mol\right)\Rightarrow m_{SO_2}=0,1.64=6,4\left(g\right)\)
c, \(n_{O_2}=n_S=0,1\left(mol\right)\Rightarrow V_{O_2}=0,1.22,4=2,24\left(l\right)\)
Bài 2:
a, \(2KClO_3\xrightarrow[MnO_2]{^{t^o}}2KCl+3O_2\)
b, Bạn xem lại đề nhé, pư không tạo thành MnO2.
Bài 3:
a, \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
b, \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{Cu}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{Cu}=0,1.64=6,4\left(g\right)\)
c, \(n_{H_2O}=n_{H_2}=0,1\left(mol\right)\Rightarrow V_{H_2O}=0,1.22,4=2,24\left(l\right)\)
d, \(n_{CuO}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{CuO}=0,1.80=8\left(g\right)\)

$m_S = 24.0,5\% = 0,12(kg)$
$m_C = 24.(100\% - 0,5\% - 1,5\%) = 23,52(kg)$
$\Rightarrow n_S = 0,00375(kmol) = 3,75(mol)$
$n_C = 1,96(kmol) = 1960(mol)$
$C + O_2 \xrightarrow{t^o} CO_2$
$S + O_2 \xrightarrow{t^o} SO_2$
Theo PTHH :
$n_{CO_2} = n_C = 1960(mol) ; n_{SO_2} = n_S = 3,75(mol)$
$\Rightarrow V_{CO_2} = 1960.22,4 = 43904(lít)$
$\Rightarrow V_{SO_2} = 3,75.22,4 = 84(lít)$

\(n_{KClO_3\left(bd\right)}=\dfrac{55,125}{122,5}=0,45\left(mol\right)\)
=> \(n_{KClO_3\left(pư\right)}=\dfrac{0,45.85}{100}=0,3825\left(mol\right)\)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
0,3825------------------->0,57375
=> \(V_{O_2}=0,57375.22,4=12,852\left(l\right)\)

Đổi: 24kg = 24000g
24kg than đá có chứa 0,5% tạp chất lưu huỳnh và 1,5% tạp chất khác không cháy được

⇒ nS = 120 / 32 = 3,75 mol
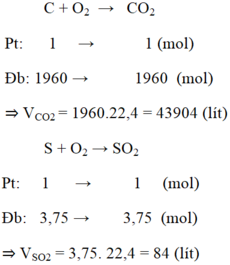

\(m_C=12\cdot\left(100-1.5-0.5\right)\%=11.76\left(kg\right)\)
\(n_C=\dfrac{11.76}{12}=0.98\left(kmol\right)\)
\(m_S=12\cdot0.5=6\left(kg\right)\)
\(n_S=\dfrac{6}{32}=0.1875\left(kmol\right)\)
\(S+O_2\underrightarrow{t^0}SO_2\)
\(C+O_2\underrightarrow{t^0}CO_2\)
\(V_{O_2}=\left(0.1875+0.98\right)\cdot22.4=26.152\left(kl\right)=26125\left(l\right)\)


Câu 1:
Phương trình phản ứng cháy của cacbon :
C + O2 -> CO2
12g 22,4(lít)
Khối lượng tạp chất lưu huỳnh và tạp chất khác là :
36. (0,5% + 1,5%) = 0,72kg = 720g.
Khối lượng cacbon nguyên chất là : 36 – 0,72 = 35,28 (kg) = 35280 (g).
Theo phương trình phản ứng, thể tích CO2 tạo thành là :
\(V_{CO_2}=\frac{35280}{12}.22,4=65856\left(l\right)\) 43904 (lít).
Phương trình phản ứng cháy của lưu huỳnh :
S + O2 -> SO2
Khối lượng tạp chất lưu huỳnh là : 36.0,5% = 0,18 kg = 180 (g)
Theo phương trình phản ứng, thể tích khí SO2 tạo thành là :
\(V_{SO_2}=\frac{180}{32}.22,4=126\left(l\right)\) (lít).
đổi 36 kg = 36000g
ta có pthh C + O2---> Co2
theo pthh 1mol 1 mol 1mol
theo đề 2940 2940 2940 (mol)
mC= 98%*36000/100%=35280g
nC= 35280/12=2940 mol
VCO2=2940*22.4=65856(lit)
Ta có pthh S + O2à SO2
Theo pthh 1mol 1mol 1mol
Theo đề 5.625 5.625 5.625 (mol)
ms= 0.5%36000/100%=180(g)
ns= 180/32=5.625mol
VS02=5.625*22.4=126(lit)