Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Gọi công thức muối là CaX2
CaX2 + 2AgNO3 → Ca(NO3)2 +2AgX
40+2X 2.(108+X)
0,2 0,376
Ta có → X=80 (Br)
Công thức. CaBr2

1)
2) Có: \(n_{H_2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
Gỉa sử R có hóa trị n.
PTHH:
\(2R+2nHCl\rightarrow2RCl_n+nH_2\)
\(\frac{0,2}{n}--------->0,1\)
\(\Rightarrow R=\frac{6,5}{\frac{0,2}{n}}=32,5n\)
Biện luận R theo n ta được: R = 65 (Kẽm - Zn) khi n = 2.
==> Chọn B.
3) Ta có: \(n_{HCl}=0,2.1+0,3.2=0,8\left(mol\right);V_{HCl}=0,2+0,3=0,5\left(l\right)\)
\(\Rightarrow C_MHCl=\frac{0,8}{0,5}=1,6\left(M\right)\)
==> Chọn C.

1. Gọi n là số mol của R và RO
nHCl = 0.4*1 = 0.4 mol
PTHH: R + 2 HCl -------> RCl2 + H2
x .................... 2x
RO + 2 HCl -> RCl2 + H2O
x ......... 2x
Ta có: 2x + 2x = 0,4 => x = 0,1
Thay x=0.1 vào Rx + (R+16)x = 6,4
<=> 0,2.R + 16.0,1 = 6,4
=> R = 24(Mg)
Vậy R là Magie và oxit là MgO.
2. Gọi n là số mol của halogen X cần tìm
PTHH : Mg +X2 ------> MgX2
n..........n................n
2Al + 3X2 --------> 2AlX3
\(\dfrac{2}{3}n\) .......n....................\(\dfrac{2}{3}n\)
Ta có: \(\left\{{}\begin{matrix}\left(24+2X\right)n=19\\\left(27+3X\right)\cdot\dfrac{2}{3}n=17.8\end{matrix}\right.\) <=> \(\left\{{}\begin{matrix}24n+2Xn=19\\18n+2Xn=17.8\end{matrix}\right.\)
=>\(\left\{{}\begin{matrix}n=0.2\\X=35.5\left(Clo\right)\end{matrix}\right.\)
Vậy halogen X cần tìm là Clo

a,
- Giả sử X là F (không tạo kết tủa) \(\Rightarrow\) Y là Cl.
\(AgNO_3+NaCl\rightarrow NaCl+AgNO_3\)
\(\rightarrow n_{NaCl}=n_{AgCl}=0,331\left(mol\right)\)
\(\Rightarrow m_{NaCl}=19,36< 22\left(g\right)\left(TM\right)\)
- Giả sử X, Y đều tạo kết tủa. Gọi chung là R.
nNaR= nAgR
\(\Rightarrow\frac{22}{23+R}=\frac{47,5}{108+R}\)
\(\Leftrightarrow47,5\left(23+R\right)=22\left(108+R\right)\)
\(\Leftrightarrow R=50,3\left(Cl;Br\right)\left(TM\right)\)
Vậy NaX, NaY có thể là NaF, NaCl hoặc NaCl, NaBr.
b,
- Trường hợp NaF, NaCl:
mNaCl= 19,36g
\(\Rightarrow C\%_{NaCl}=\frac{19,36.100}{200}=9,68\%\)
\(m_{NaF}=22-19,36=2,64\left(g\right)\)
\(\Rightarrow C\%_{NaF}=\frac{2,64.100}{200}=1,32\%\)
Trường hợp NaCl, NaBr
Gọi x là mol NaCl; y là mol NaBr
Bảo toàn nguyên tố, n muối= n kết tủa
\(\Rightarrow58,5x+103y=22;143,5x+188y=47,5\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(C\%_{NaCl}=\frac{0,2.58,5.100}{200}=5,85\%\)
\(C\%_{NaBr}=\frac{0,1.103.100}{200}=5,15\%\)

Sansi chút @@@@
Tại sao bài này cx phải cắt nhỉ :)) Mà chữ Linh khác nhiều nhỉ không biết có gì sau không ta
Rồi sao không rep lại vậy có gì đen tối quá hay sao ta
À có khi thằng bạn thấy dễ hộ làm rồi tiện đăng vô đây hay sao nữa

nAg = 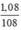 = 0,01 mol
= 0,01 mol
Phương trình hóa học của phản ứng:
Đặt X là kí hiệu, nguyên tử khối của halogen
NaX + AgNO3 → AgX↓ + NaNO3
0,01mol 0,01mol
2AgX → 2 Ag + X2
0,01mol 0,01mol
Theo pt: nNaX = nAgX = nAg = 0,1 mol
MNaX = 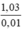 = 103 → X = 103 – 23 = 80 (Br)
= 103 → X = 103 – 23 = 80 (Br)
Muối A có công thức phân tử là NaBr

Bài 1:
\(2KI+Cl_2\rightarrow2KCl+I_2\)
Ta có: \(n_{I2}=\frac{3,81}{254}=0,015\left(mol\right)\)
\(\rightarrow n_{KI}=2n_{I2}=2.0,015=0,03\left(mol\right)\)
\(\Rightarrow CM_{KI}=\frac{0,03}{0,1}=0,3M\)
Bài 2:
\(2NaCl+H_2SO_4\rightarrow Na_2SO_4+2HCl\)
Ta có: \(n_{HCl}=0,2\left(mol\right)\)
\(\rightarrow n_{NaCl}=n_{HCl}=0,2\left(mol\right)\)
\(\Rightarrow m_{NaCl}=0,2.58,5=11,7\left(g\right)\)
Vậy a= 11,7 (g)
Bài 3:\(SiO_2+4HF\rightarrow SiF_4+2H_2O\)
0,1____________ 0,1_______
\(\rightarrow m_{SiF4}=10,4\left(g\right)\)
Bài 4:
\(2Fe+3Br_{2_{du}}\rightarrow2FeBr_3\)
0,01______________0,01
\(\rightarrow m_{Fe}=0,56\left(g\right)\)
Bài 5:
\(2Al+3I_2\underrightarrow{^{to,H2O}}2AlI_3\)
Ta có: \(n_{AlI3}=\frac{8,16}{408}=0,02\left(mol\right)\)
\(\Rightarrow n_{I2}=1,5n_{AlI3}=1,5.0,02=0,03\left(mol\right)\)
\(\Rightarrow m_{I_2}=0,03.254=7,62\left(g\right)\)
Bài 6:
\(3I_2+6NaOH\rightarrow5NaI+NaIO_3+3H_2O\)
______________0,05____0,01 _____________
\(n_{NaIO3}=\frac{1,98}{198}=0,1\left(mol\right)\)
\(\Rightarrow n_{NaI}=5n_{NaIO3}=5.0,1=0,5\left(mol\right)\)
\(\Rightarrow m_{NaI}=a=0,05.150=7,5\left(g\right)\)
Bài 7:
Gọi Halogen đó là X:
\(3X_2+2Fe\underrightarrow{^{to}}2FeX_3\)
Ta có: \(n_{FeX3}=\frac{8,88}{56+3X}\left(mol\right)\)
\(\Rightarrow n_{X2}=1,5n_{FeX3}=1,5\left(\frac{8,88}{56+3X}\right)=\frac{13,32}{56+3X}\left(mol\right)\left(1\right)\)
\(X_2+Mg\underrightarrow{^{to}}MgX_2\)
Ta có: \(n_{MgX2}=\frac{8,28}{24+2X}\left(mol\right)\)
\(\Rightarrow n_{X2}=n_{MgX2}=\frac{8,28}{24+2X}\left(2\right)\)
Vì (1) = (2) \(\Rightarrow\frac{13,32}{56+3X}=\frac{8,28}{24+2X}\)
\(\Rightarrow X=80\)
Vậy X là Br





