Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cu ko phản ứng với H2SO4 loãng
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,1.65=6,5\left(g\right)\Rightarrow m_{Cu}=4\left(g\right)\)
\(\Rightarrow\%Zn=\dfrac{6,5}{10,5}=62\%;\%Cu=100\%-62\%=28\%\)

Z n + H 2 S O 4 → Z n S O 4 + H 2
Cu không tác dụng với axit Sunfuric.
⇒ n Z n = n H 2 = 2,24/22,4 = 0,1 mol
⇒ m Z n = 0,1.65 = 6,5g
⇒ m C u = m r a n c o n l a i = 10,5 - 6,5 =4g
⇒ Chọn B.

a)
Chất rắn còn lại sau phản ứng là Cu vì Cu không phản ứng với dung dịch sunfuric 0,5M
\(Zn + H_2SO_4 \to ZnSO_4 + H_2\)
Theo PTHH : \(n_{Zn} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)\)
\(\Rightarrow m_{Cu} = m_{hỗn\ hợp} - m_{Zn} = 10,5 - 0,1.65 = 4(gam)\)
b)
Ta có : \(n_{H_2SO_4} = n_{ZnSO_4} = n_{H_2} = 0,1(mol)\)
Suy ra :
\(V_{H_2SO_4} = \dfrac{0,1}{0,5} = 0,2(lít)\\ m_{ZnSO_4} = 0,1.161 = 16,1(gam)\)

Zn+ H2SO4→ ZnSO4+ H2↑
(mol) 0,1 0,1 0,1
a)
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{2,24}{22,4}=0,1\left(lít\right)\)
→mZn=n.M=0,1.65= 6,5(g)
→mCu= 10- 6,5= 3,5(g)
=> \(\%m_{Zn}=\dfrac{6,5}{10}.100\%=65\%\)
\(\%m_{Cu}=100\%-65\%=35\%\)
b) \(C_{M_{H_2SO_4}}=\dfrac{n}{V}=\dfrac{0,1}{0,1}=1M\)

- Cu không tác dụng được với dd H2SO4 loãng.
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ n_{Zn}=n_{H_2}=0,1\left(mol\right)\\ \Rightarrow\%m_{Zn}=\dfrac{0,1.65}{10,5}.100\approx61,905\%\\ \Rightarrow\%m_{Cu}\approx38,095\%\)
anh giúp em bài này với https://hoc24.vn/cau-hoi/giup-minh-voi-trong-tam-giai-thich-ki-cai-de-nha-cam-on.2017646398420

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ a,Zn+H_2SO_4\to ZnSO_4+H_2\\ b,n_{Zn}=0,1(mol)\Rightarrow m_{Zn}=0,1.65=6,5(g)\\ \Rightarrow \%_{Zn}=\dfrac{6,5}{10,5}.100\%=61,9\%\\ \Rightarrow \%_{Cu}=100\%-61,9\%=38,1\%\\ c,n_{H_2SO_4}=0,1(mol)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,1}{0,5}=0,2M\)
0.1 0.1
nH2= 2.24: 22.4=0.1 mol
mZn= 0.1x65=6.5 g
mCu=10.5-6,5=4 g
%Zn=6.5:10.5x100%=61.9%
%Cu=4:10.5x100%=38.1%

Chọn B
Chỉ có Zn phản ứng với H 2 S O 4 , Cu không phản ứng


PTHH : Zn +HCl →ZnCl2 + H2
Theo bài ra : số mol của H2 =0,15 (MOL)
Theo pt ⇒ nZn=nH2=0,15( mol)
⇒mZn=9,75⇒mCu=21-9,75=11,25(g)
%Zn=9,75/21.100%=46,43%
%Fe=100%-46,43%=53.57%
câu a

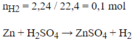

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ n_{Zn}=n_{H_2}=0,1mol\\ \%m_{Zn}=\dfrac{0,1.65}{10,5}\cdot100=61,9\%\\ \%m_{Cu}=100-61,9=38,1\%\)