Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Cu}=\dfrac{12.8}{64}=0.2\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(0.2......0.2.....0.2\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(m_{CuO}=0.2\cdot80=16\left(g\right)\)

a) \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
0,2--------------------->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
b) \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\) => H2 hết, CuO dư
PTHH: CuO + H2 --to--> Cu + H2O
0,2<--0,2-------->0,2
=> mrắn sau pư = 24 - 0,2.80 + 0,2.64 = 20,8 (g)
c)
PTHH: RO + H2 --to--> R + H2O
0,2------>0,2
=> \(M_R=\dfrac{12,8}{0,2}=64\left(g/mol\right)\)
=> R là Cu
+) \(N_{Mg}\) = \(\dfrac{m}{M}\) = \(\dfrac{4,8}{24}\) = 0,2 mol
a) Mg + HCl -> \(MgCl_2\) + \(H_2\)
0,2 -> 0,2 (mol)
b) +) \(N_{CuO}\text{ }\)= \(\dfrac{m}{M}\) = \(\dfrac{24}{80}\) = 0,3 mol
+) \(H_2\) + CuO -> Cu + \(H_2O\)
+) Ta có: \(\dfrac{N_{H_2}}{1}\)= \(\dfrac{0,2}{1}\) < \(\dfrac{N_{CuO}}{1}\)= \(\dfrac{0,3}{1}\)
=> \(H_2\) hết. Tính toán theo \(N_{H_2}\)
+)\(H_2\) + CuO -> Cu + \(H_2O\)
Ban đầu: 0,2 0,3 0 0 }
P/ứng: 0,2 -> 0,2 -> 0,2 -> 0,2 } mol
Sau p/ư: 0 0,1 0,2 0,2 }
=> \(m_{Cu}\) = 12,8 gam .Thu được 2,8 gam Cu

a) PTHH : \(2Al+6HCl-->2AlCl_3+3H_2\) (1)
\(Fe+2HCl-->FeCl_2+H_2\) (2)
\(H_2+CuO-t^o->Cu+H_2O\) (3)
b) Ta có : \(m_{CR\left(giảm\right)}=m_{O\left(lay.di\right)}\)
=> \(m_{O\left(lay.di\right)}=32-26,88=5,12\left(g\right)\)
=> \(n_{O\left(lay.di\right)}=\frac{5,12}{16}=0,32\left(mol\right)\)
Theo pthh (3) : \(n_{H_2\left(pứ\right)}=n_{O\left(lay.di\right)}=0,32\left(mol\right)\)
=> \(tổng.n_{H_2}=\frac{0,32}{80}\cdot100=0,4\left(mol\right)\)
Đặt \(\hept{\begin{cases}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{cases}}\) => \(27a+56b=11\left(I\right)\)
Theo pthh (1) và (2) : \(n_{H_2\left(1\right)}=\frac{3}{2}n_{Al}=\frac{3}{2}a\left(mol\right)\)
\(n_{H_2\left(2\right)}=n_{Fe}=b\left(mol\right)\)
=> \(\frac{3}{2}a+b=0,4\left(II\right)\)
Từ (I) và (II) => \(\hept{\begin{cases}a=0,2\\b=0,1\end{cases}}\)
=> \(\hept{\begin{cases}m_{Al}=27\cdot0,2=5,4\left(g\right)\\m_{Fe}=56\cdot0,1=5,6\left(g\right)\end{cases}}\)

a)
\(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,2-------------->0,2--->0,1
=> Chất tan trong dd X là NaOH
mNaOH = 0,2.40 = 8 (g)
mdd sau pư = 4,6 + 59,6 - 0,1.2 = 64 (g)
=> \(C\%=\dfrac{8}{64}.100\%=12,5\%\)
b)
PTHH: CuO + H2 --to--> Cu + H2O
0,1------>0,1
=> mCu = 0,1.64 = 6,4 (g)

2. \(1.n_{H_2}=0,1\left(mol\right);n_{CuO}=0,15\left(mol\right)\\ H_2+CuO-^{t^o}\rightarrow Cu+H_2O\\ LTL:\dfrac{0,1}{1}< \dfrac{0,15}{1}\Rightarrow CuOdư\\ n_{CuO\left(pư\right)}=n_{H_2}=0,1\left(mol\right)\\ n_{CuO\left(dư\right)}=0,15-0,1=0,05\left(mol\right)\\ \Rightarrow m_{CuO\left(dư\right)}=4\left(g\right)\\ 2.n_{H_@}=n_{Cu}=0,1\left(mol\right)\\ \Rightarrow m_{Cu}=0,1.64=6,4\left(g\right)\)
Bài 9:
Gọi hóa trị của M là x(x>0)
\(n_{H_2}=\dfrac{1,008}{22,4}=0,045(mol)\\ \text {Bảo toàn O: }n_{O/oxit}=n_{H_2}=\dfrac{1,344}{22,4}=0,06(mol)\\ \Rightarrow m_{M}=m_{oxit}-m_{O_2}=3,48-0,06.16=2,52(g)\\ PTHH:2M+2xHCl\to 2MCl_x+xH_2\\ \Rightarrow n_{M}=\dfrac{2.0,045}{x}=\dfrac{0,09}{x}\\ \Rightarrow M_{M}=\dfrac{2,52}{\dfrac{0,09}{x}}=28x\)
Thay \(x=2\Rightarrow M_M=56(Fe)\)
\(\Rightarrow n_{Fe}=\dfrac{2,52}{56}=0,045(mol)\\ \Rightarrow \dfrac{n_{Fe}}{n_{O}}=\dfrac{0,045}{0,06}=\dfrac{3}{4}\)
Vậy M là sắt (Fe) và CTHH oxit là \(Fe_3O_4\)

Bài 12:
\(\text{Đ}\text{ặt}:X\left(a\right)\left(x:nguy\text{ê}n,d\text{ư}\text{ơn}g\right)\\ 2X+2aHCl\rightarrow2XCl_a+H_2\\ n_{H_2}=\dfrac{4,704}{22,4}=0,21\left(mol\right)\\ \Rightarrow n_X=0,21.2=0,42\left(mol\right)\\ M_X=\dfrac{3,78}{0,42}=9\left(\dfrac{g}{mol}\right)\\ \Rightarrow X:B\text{er}i\left(Be=9\right)\)

\(n_{Zn}=\dfrac{19.5}{65}=0.3\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{98}{98}=1\left(mol\right)\)
\(n_{CuO}=\dfrac{36}{80}=0.45\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.3.....................................0.3\)
\(CuO+H_2\underrightarrow{t^0}Cu+H_2O\)
\(0.3.......0.3.....0.3....0.3\)
\(m_{Cr}=m_{CuO\left(dư\right)}+m_{Cu}=\left(0.45-0.3\right)\cdot80+0.3\cdot64=31.2\left(g\right)\)
\(m_{H_2O}=0.3\cdot18=5.4\left(g\right)\)
Chúc em học tốt !!
Zn+H2SO4→ZnSO4+H2 bạn biến đổi nó ra phương trình này kiểu gì vậy?

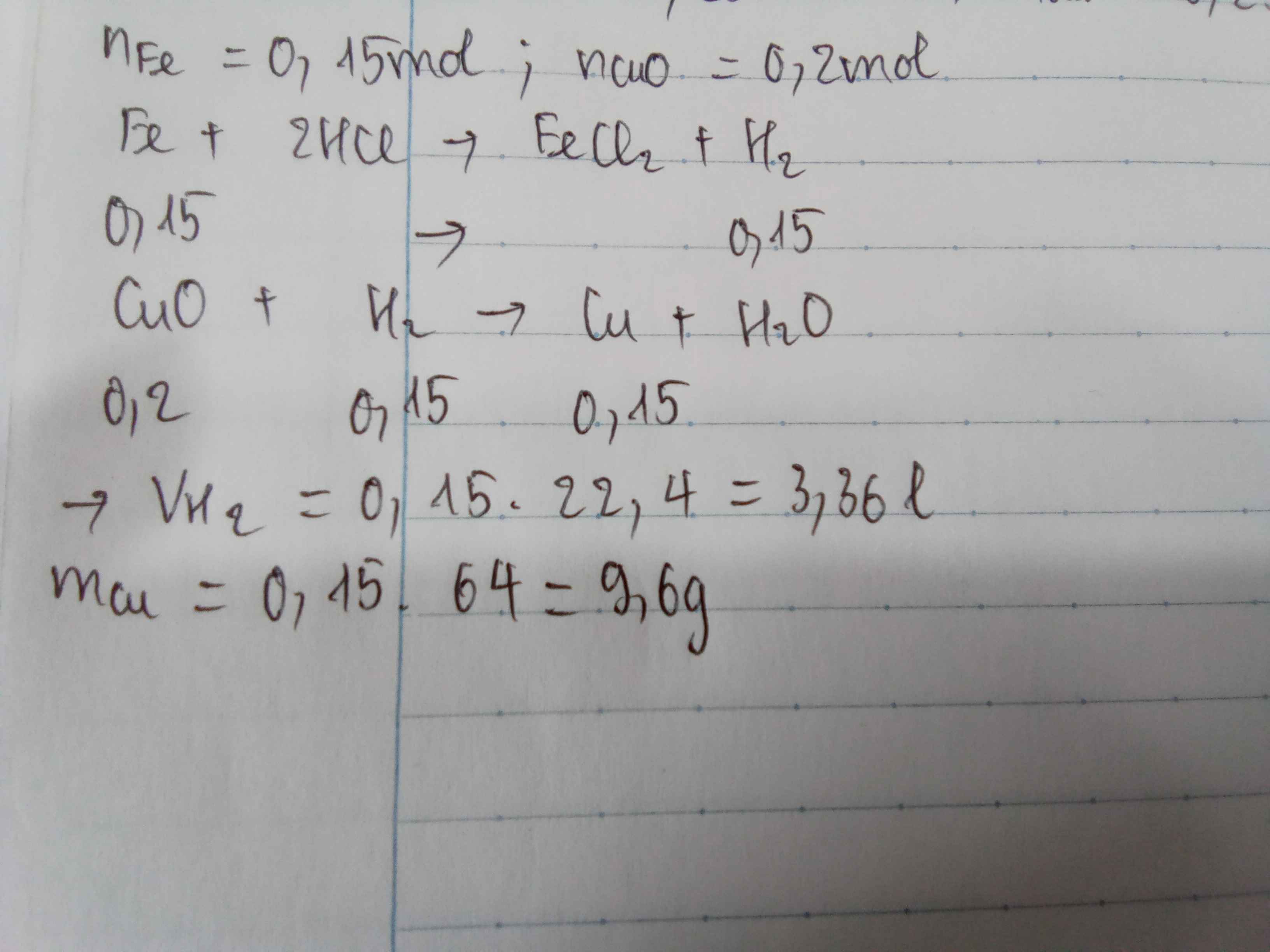



CuO+H2to→Cu+H2O
Theo PT: nCuO=nCu(1)
Ta có mrắngiảm=mCuO−mCu=3,2(g)
→80nCuO−64nCu=3,2(2)
Từ (1)(2)→nCuO=nCu=\(\dfrac{3,2}{80-64}\)=0,2(mol)(1)(2)
→nCuO=nCu=3,280−64=0,2(mol)
Theo PT: nH2=nCu=0,2(mol)
Đặt hóa trị R là n(n>0)
2R+2nHCl→2RCln+nH2
Theo PT: nR.n=2nH2
→\(\dfrac{13n}{MR}\)=0,4
→MR=32,5n
Với n=2→MR=65(g/mol)
→R là kẽm (Zn)