Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Fe + 2HCl --> FeCl2 + H2
b) \(n_{HCl}=\dfrac{36,5.30}{100.36,5}=0,3\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
_____0,15<-0,3-------------->0,15
=> \(\%Fe=\dfrac{0,15.56}{8,8}.100\%=95,45\%\)
=> \(\%Cu=\dfrac{8,8-0,15.56}{8,8}.100\%=4,55\%\)
c) VH2 = 0,15.22,4 = 3,36(l)

Chất rắn ko tan là Cu
Đặt \(n_{Mg}=x(mol);n_{Al}=y(mol)\Rightarrow 24x+27y=13-4=9(1)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45(mol)\\ PTHH:Mg+2HCl\to MgCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow x+1,5y=0,45(2)\\ (1)(2)\Rightarrow x=0,15(mol);y=0,2(mol)\\ a,\%_{Cu}=\dfrac{4}{13}.100\%=30,77\%\\ \%_{Mg}=\dfrac{0,15.24}{13}.100\%=27,69\%\\ \%_{Al}=100\%-30,77\%-27,69\%=41,54\%\\ b,\Sigma n_{HCl}=2x+3y=0,9(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,9}{2}=0,45(l)\)

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

a, Ta có: 24nMg + 56nFe = 12,8 (1)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,3\left(mol\right)\\n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,3.24=7,2\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
b, \(n_{HCl}=2n_{H_2}=0,8\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,8}{2}=0,4\left(l\right)\)
c, \(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
Theo PT: \(\left\{{}\begin{matrix}n_{Mg\left(OH\right)_2}=n_{MgCl_2}=n_{Mg}=0,3\left(mol\right)\\n_{Fe\left(OH\right)_2}=n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{\downarrow}=0,3.58+0,1.90=26,4\left(g\right)\)
a. Số gam mỗi kim loại trong hỗn hợp ban đầu:
Mg: 9,6 gamFe: 22,4 gamb. Thể tích dung dịch HCl 2M đã phản ứng: 0,2 lít
c. Khối lượng kết tủa thu được khi dd A tác dụng với dung dịch NaOH dư là 0,4 gam.
------------------------------------đấy

a. Số mol của CO là: nCO = 2.24/22.4=0.1 mol
Gọi x là số mol của CuO có trong hỗn hợp và y là số mol của Fe3O4 có trong hỗn hợp.
Khi cho hỗn hợp đi qua CO nung nóng thì chỉ có:
CuO + CO ----t0----> Cu+CO2
x x x
Fe3O4 + 4CO ---- to -----> 3Fe + 4CO2
y 4y 3y
Theo phương trình (1) và (2) ta có: x + 4y = 0,1 (*)
Vì Al2O3 không tham gia phản ứng với CO, do vậy hỗn hợp chất rắn thu được sau khi phản ứng gồm Al2O3, Cu và Fe.
- Phần 1: Chỉ có Fe và Al2O3 tham gia phản ứng với axit HCl theo phương trình: Fe + 2HCl ----> FeCl2 + H2
\(\dfrac{3y}{2}\) 0.03
\(\dfrac{3y}{2}\) = 0,03 (**) => y = 0,02 mol
Thay y = 0,02 vào (*), giải ra ta được x = 0,02 mol
Al2O3 + 6HCl 2AlCl3 + 3H2O
- Phần 2: Chỉ có Al2O3 tham gia phản ứng với NaOH dư.
Số mol của NaOH lúc ban đầu là: n = CM. V = 0,2 x 0,4 = 0,08 mol
Số mol của HCl là: n = CM. V = 1 x 0,02 = 0,02 mol
Vì NaOH còn dư được trung hòa với axit clohidric theo phương trình:
NaOHdư + HCl -> NaCl + H2O
0,02 0,02
Do vậy, số mol NaOH tham gia phản ứng với Al2O3 là: 0,08 – 0,02 = 0,06 mol
PTHH: Al2O3 + NaOH ------>2 NaAlO2 + H2O
0,03 0,06
Số mol Al2O3: nAl2O3 = \(\dfrac{1}{2}\) n NaOH = 0,03 mol
Số mol Al2O3 có trong hỗn hợp ban đầu là: 0,03 x 2 = 0,06 mol
b. Thành phần % khối lượng mỗi chất trong hỗn hợp ban đầu.
khối lượng của hỗn hợp là:
0,006 x 102 + 0,02 x 80 + 0,02 x 216 = 12,04 g
% Al2O3 =\(\dfrac{0.06\cdot102}{12.04}\) x100% = 50,83%
% CuO = \(\dfrac{0.02\cdot80}{12.04}\) x100% = 13,29%
% Fe3O4 = \(\dfrac{0.02\cdot216}{12.04}\)x100% = 35,88%
Vì Cu không tác dụng được với HCl -> chất rắn
\(m_{hh}=5,12-1,92=3,2\left(g\right)\)
\(n_{H_2}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
\(n_{HCl}=0,15.2=0,5\left(mol\right)\)
Pt: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)(1)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (2)
\(n_{HCl}:n_{H_2}=0,25>0,08\)
H2 hết; HCl dư
Gọi x, y lần lượt là số mol của Mg, Fe
(1)(2) \(\Rightarrow\left\{{}\begin{matrix}24x+56y=3,2\\x+y=0,08\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}x=0,04\\y=0,04\end{matrix}\right.\)
\(m_{Mg}=0,04.24=0,96\left(g\right)\)
\(m_{Fe}=3,2-0,96=2,24\left(g\right)\)
c) \(n_{Cu}=\dfrac{1,92}{64}=0,03\left(mol\right)\)
Pt: \(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\)
0,03mol-------------------------- \(\rightarrow0,03mol\)
\(V_{SO_2}=0,03.22,4=0,672\left(l\right)\)

\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)

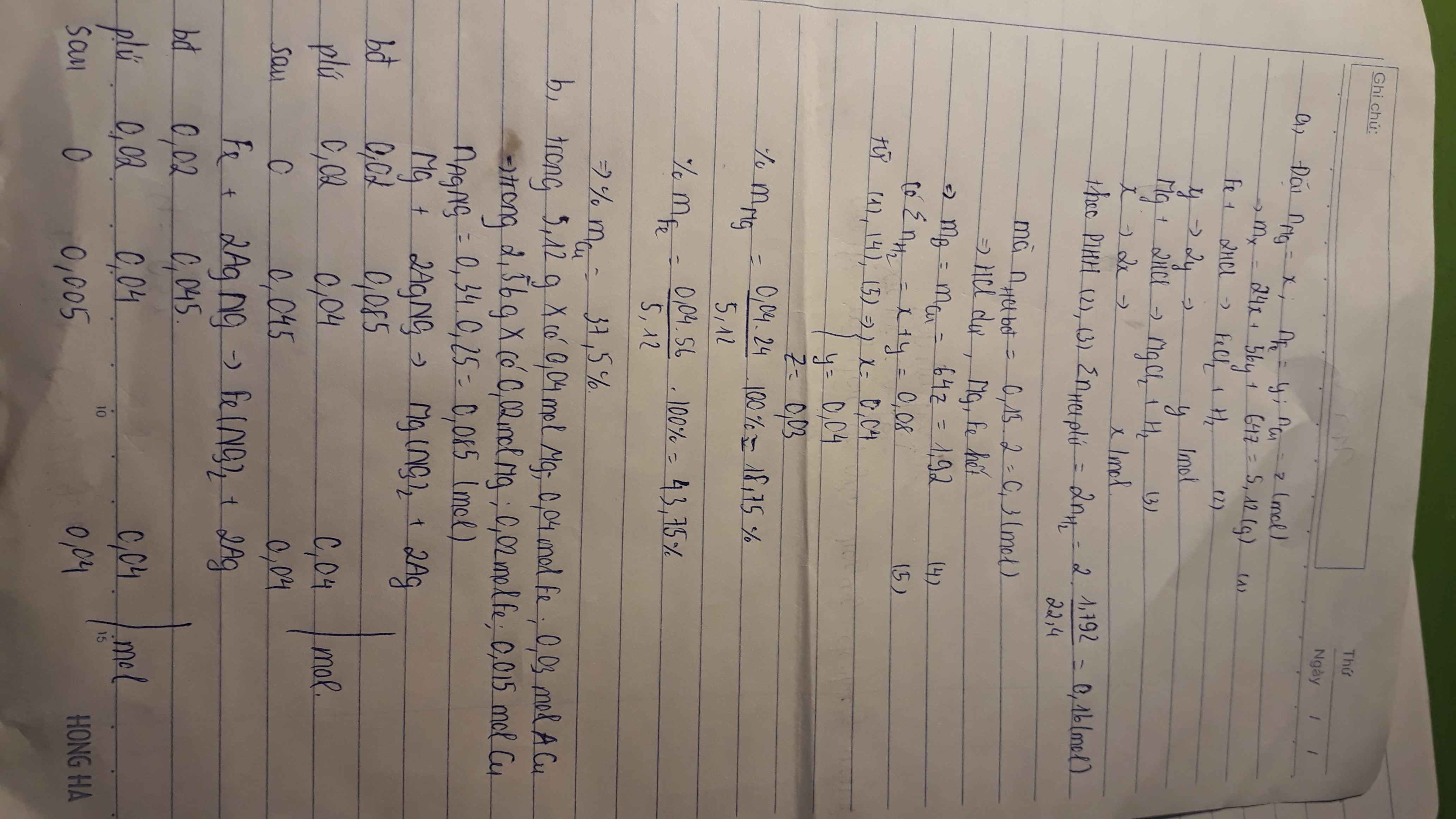
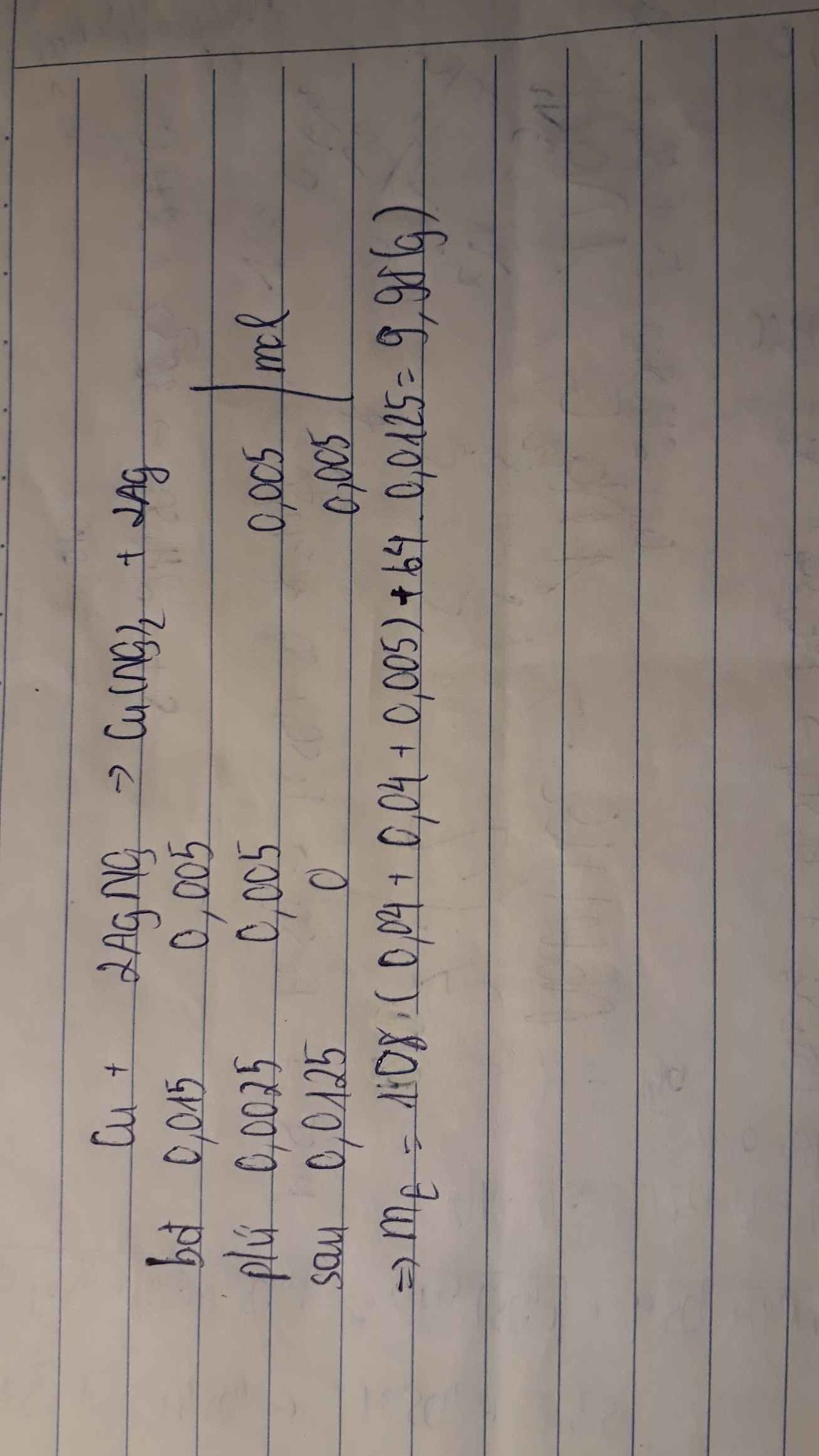

Mg + 2HCl -> MgCl2 + H2 (1)
Fe + 2HCl -> FeCl2 + H2 (2)
mCu=0,48(g)
mMg;Fe=4,28-0,48=3,8(g)
nH2=0,02(mol)
Đặt nMg=a
nFe=b
Ta có:
\(\left\{{}\begin{matrix}24a+56b=3,8\\a+b=0,02\end{matrix}\right.\)
=>a=
sao âm nhỉ
Em kiểm tra lại đề nhé, giải ra số liệu âm rồi