Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

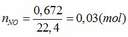
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
a → 4a → a → a (mol)
3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO + 4H2O (2)
B → 8/3b → b →2/3b (mol)
TH1: xảy ra phản ứng (1) tạo muối Fe(NO3)3 => nFe(NO3)3 = nNO = 0,03 (mol)
=> mmuối = mFe(NO3)3 = 0,03. 242 = 7,26 (g) # 7,82 => loại
TH2: xảy ra phản ứng (2) tạo muối Fe(NO3)2 => nFe(NO3)2 = 3/2 nNO = 3/2 . 0,03 = 0,045 (mol)
=> mmuối = mFe(NO3)2 = 0,045. 180 = 8,1 (g) # 7,82 => loại
TH3: xảy ra cả (1) và (2) phản ứng tạo 2 muối.
Gọi số mol của Fe ở phản ứng (1) và (2) lần lượt là a và b (mol)
Đặt vào phương trình ta có:
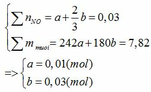
∑ nFe = 0,01 + 0,03 = 0,04 (mol) => mFe = 0,04.56 = 2,24 (g)
∑ nHNO3 pư = 4a + 8/3b = 4. 0,01 + 8/3. 0,03 = 0,12 (mol)
mHNO3 = 0,12.63 = 7,56 (g)
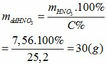
Khối lượng dd sau: mdd sau = mFe + mddHNO3 - mNO = 2,24 + 30 – 0,03.30 = 31,34 (g)
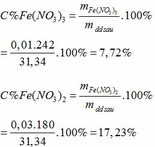

Chọn C
Gọi số mol của Fe và Al lần lượt là x và y mol

Muối trong dung dịch A gồm x mol F e S O 4 và 0,5y mol A l 2 ( S O 4 ) 3


n HCl = \(0,796.2\) =1,592 (mol)
n H2 = \(\dfrac{4,368}{22,4}\)=0,195 (mol)
Bảo toàn nguyên tố H
=> n H2O =\(\dfrac{1,592-0,195.2}{2}\) = 0,601 (mol)
=> m H2O = 10,818 g
Áp dụng định luật bảo toàn khối lượng :
m muối khan = m hỗn hợp + m axit - m H2O - mH2
=> 26,43 + 1,592.36,5 - 10,818 - 0,195.2
= 73,33 g

a)
$RCO_3 + 2HCl \to RCl_2 + CO_2 + H_2O$
$R_2(CO_3)_3 + 6HCl \to 2RCl_3 + 3CO_2 + 3H_2O$
b)
Theo PTHH :
$n_{H_2O} = n_{CO_2} = \dfrac{0,672}{22,4} = 0,03(mol)$
$n_{HCl} = 2n_{CO_2} = 0,06(mol)$
Bảo toàn khối lượng :
$m_{muối} = 10 + 0,06.36,5 - 0,03.44 - 0,03.18 = 10,33(gam)$

a) n Fe2O3 = 8/160= 0,05 (mol)
Fe2O3 + 3H2SO4 ------------> Fe2(SO4)3 + 3H2O
n Fe2O3= n Fe2(SO4)3 = 0,05 (mol)
m Fe2(SO4)3 = 0,05.400=20(g)
b) n SO2 = 0,2 (mol)
Do cho vào nước vôi trong dư
=> SO2 + Ca(OH)2 -------> CaSO3 + H2O
n SO2 = n CaSO3 = 0,2 (mol)
=> m CaSO3 = 0,2. 120= 32(g)

Cu ko td với HCl => rắn sau p/ứ là Cu
=>m (Mg, Al)=9,14-2,54=6,6g
pt: Kloai + HCl -> muối + H2
nH2=0,35mol=>nHCl=2nH2=0,7 mol
AD ĐLBT khối lượng:
m kim loại p/ứ + mHCl = m Muối + mH2
=> m Muối = 6,6 + 0,7.36,5 - 0,35.2=31,45g
=> đáp án A

đáp án A nhá
ta có nH2=0,35mol
mặt khác theo bảo toàn e ta có 2(H+) + 2e-> H2
0,7mol<-------0,35mol
mặt khác HCL =(H+) + Cl-
0,7mo<--0,7mol
theo bảo toàn khối lg
m(kim loại pư)+m(hcl)=m(muối) + m(h2) ( do kim loại dư hcl hết)
m muối=(m kim loại thực tế - m kim loại dư) + m(hcl) -m(h2)
=(9,14-2,54)+(0,7.36.5)-(0,35.2)=31,45g

Khi chuyển từ muối cacbonat thành muối Cloura, thì cứ 1 mol CO2\(\uparrow\).
CO223 chuyển thành 2Cl → 1 mol CO2↑
60 g chuyển thành 71 g khối lượng tăng 11g.
Theo giả thiết :
\(n_{C\text{O2}}=\frac{0,672}{22,4}=0,03\left(mol\right)\)
Khi khô cạn dung dịch thu được muối Cloura.
Tổng khối lượng muối Cloura là : 10 + 0,03 . 11 = 10,33 (g)




bảo toàn Electron: \(Al\rightarrow Al^{3+}+3e\)
\(5N^{5+}+10e\rightarrow N_2\)
\(n_{N_2}=0,03mol\)
\(\rightarrow3n_{Al}=10n_{N_2}\)
\(\rightarrow n_{Al}=0,1mol\)
\(\rightarrow n_{Al\left(NO_3\right)_3}=n_{Al}=0,1mol\)
\(\rightarrow m_{Al\left(NO_3\right)_3}=21,3g< 40,74g\)
Vậy có muối \(NH_4NO_3\) tạo thành
\(Al\rightarrow Al^{3+}+3e\)
\(2N^{5+}+10e\rightarrow N_2\)
\(2N^{5+}+8e\rightarrow NH_4^+\)
\(\rightarrow3n_{Al}=10n_{N_2}+8n_{NH_4NO_3}\)
\(\rightarrow3n_{Al}-8n_{NH_4NO_3}=0,3\)
\(m_{Al\left(NO_3\right)_2}+m_{NH_4NO_3}=40,74mol\)
\(\rightarrow213n_{Al}+80n_{NH_4NO_3}=40,74\)
Giải hệ phương trình: \(\hept{\begin{cases}3n_{Al}-8n_{NH_4NO_3}=0,3\\213n_{Al}+80n_{NH_4NO_3}=40,74\end{cases}}\)
\(\rightarrow n_{Al}=0,18mol\)
\(\rightarrow n_{NH_4NO_3}=0,03mol\)
\(\rightarrow m=m_{Al}=4,86g\)