Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{MnO_2}=\dfrac{69,6}{87}=0,8\left(mol\right)\)
nKOH = 0,5.4 = 2(mol)
PTHH: MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,8------------------------>0,8
2KOH + Cl2 --> KCl + KClO + H2O
Xét tỉ lệ \(\dfrac{2}{2}>\dfrac{0,8}{1}\) => KOH dư, Cl2 hết
2KOH + Cl2 --> KCl + KClO + H2O
1,6<--0,8---->0,8---->0,8
=> \(\left\{{}\begin{matrix}n_{KOH\left(dư\right)}=2-1,6=0,4\left(mol\right)\\n_{KCl}=0,8\left(mol\right)\\n_{KClO}=0,8\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(KOH\right)}=\dfrac{0,4}{0,5}=0,8M\\C_{M\left(KCl\right)}=\dfrac{0,8}{0,5}=1,6M\\C_{M\left(KClO\right)}=\dfrac{0,8}{0,5}=1,6M\end{matrix}\right.\)

35. Cho 15g MnO2 ( chứa 13% tạp chất trơ) tác dụng hết với dd HCl đặc dư , khí thoát ra đc hấp thụ hết vào 400ml dd NaOH 1M ở nhiệt độ thường. Tổng nồng độ mol /l của muối tạo thành?
----
mMnO2= (100%-13%).15=13,05(g)
=>nMnO2= 13,05/87=0,15(mol)
nNaOH= 1.0,4= 0,4(mol)
PTHH: MnO2 + 4 HCl(đ) -to-> MnCl2 + Cl2 + 2 H2O
0,15_________0,6_________0,15___0,15(mol)
Cl2 + 2 NaOH \(\leftrightarrow\) NaCl + NaClO + H2O
0,15_0,3_____0,15____0,15(mol)
Ta có: 0,4/2 > 0,15/1
=> Cl2 hết, NaOH dư, tính theo nCl2
Vddsau= VddNaOH= 0,4(l)
Tổng nồng độ mol dung dịch muối tạo thành:
\(C_{MddNaCl}+C_{MddNaClO}=\frac{0,15}{0,4}+\frac{0,15}{0,4}=0,75\left(M\right)\)

MnO 2 + HCl → MnCl 2 + Cl 2 + 2 H 2 O
Cl 2 + 2NaOH → NaCl + NaClO + H 2 O
n MnO 2 = 0,2 mol; n NaOH = 0,729 mol
Theo phương trình (1) ta có: n Cl 2 = n MnO 2 = 0,2 mol
Theo phương trình (2) ta có: 2 n Cl 2 < n NaOH ⇒ NaOH dư
Dung dịch A gồm: n NaCl = n NaClO = n Cl 2 = 0,2 mol
n NaOH dư = 0,729 – 2.0,2 = 0,329 mol
m dd A = m Cl 2 + m dd NaOH = 0,2.71 + 145,8 = 160g
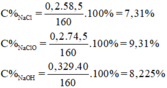

Phản ứng xảy ra:
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
Ta có:
\(n_{MnO2}=\frac{13,05}{55+16.2}=0,15\left(mol\right)\)
\(\Rightarrow n_{Cl2}=n_{MnO2}=0,15\left(mol\right)\)
\(2NaOH+Cl_2\rightarrow NaCl+NaClO+H_2O\)
Vì \(n_{NaOH}=0,5.1=0,5\left(mol\right)>2nCl_2\)
Nên NaOH dư.
\(\Rightarrow n_{NaCl}=n_{NaClO}=n_{Cl2}=0,15\left(mol\right)\)
\(n_{NaOH\left(Dư\right)}=0,5-0,15.2=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}CM_{NaCl}=\frac{0,15}{0,5}=0,3M\\CM_{NaClO}=\frac{0,15}{0,5}=0,3M\\CM_{NaOH\left(dư\right)}=\frac{0,2}{0,5}=0,4M\end{matrix}\right.\)

\(a) n_{Na_2CO_3} = \dfrac{2,12}{106} = 0,02(mol) ; n_{HCl} = 0,5.0,1 = 0,05(mol)\\ Na_2CO_3 + 2HCl \to 2NaCl + CO_2 + H_2O\\ Vì :2n_{Na_2CO_3} = 0,04 < n_{HCl} = 0,05\ nên\ HCl\ \text{dư}\\ n_{CO_2} = n_{Na_2CO_3} = 0,02(mol)\\ V_{CO_2} = 0,02.22,4 = 0,448(lít)\\ b) n_{HCl\ dư} = n_{HCl\ ban\ đầu} - 2n_{Na_2CO_3} = 0,05 -0,02.2 = 0,01(mol)\\ n_{NaCl} = 2n_{Na_2CO_3} = 0,02.2 = 0,04(mol)\\ C_{M_{HCl}} = \dfrac{0,01}{0,5} = 0,02M\\ C_{M_{NaCl}} = \dfrac{0,04}{0,5} = 0,08M\)

a)\(\left\{{}\begin{matrix}Fe:a\left(mol\right)\\Al:b\left(mol\right)\end{matrix}\right.\)⇒ 56a + 27b = 1,93(1)
\(Fe + 2HCl \to FeCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\)
Theo PTHH : a + 1,5b = \(\dfrac{1,456}{22,4} = 0,065\)(2)
Từ (1)(2) suy ra : a = 0,02 ; b = 0,03
Vậy :
\(\%m_{Fe} = \dfrac{0,02.56}{1,93}.100\% = 58,03\%\\ \%m_{Al} = 100\% - 58,03\% = 41,97\%\)
b)
\(C_{M_{FeCl_2}} = \dfrac{0,02}{0,2} = 0,1M\\ C_{M_{AlCl_3}} = \dfrac{0,03}{0,2} = 0,15M\)
c)
\(n_{HCl} = 2n_{H_2} = 0,065.2 = 0,13(mol)\\ a = \dfrac{0,13}{0,2} = 0,65(M)\)

\(n_{KMnO_4} = \dfrac{15,8}{158} = 0,1(mol)\\ n_{HCl} = 0,08.2 = 0,16(mol)\)
2KMnO4 + 16HCl \(\to\) 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,02.............0,16...................................0,05..............(mol)
\(n_{NaOH} = 0,2.1,5 = 0,3(mol)\)
2NaOH + Cl2 \(\to\) NaCl + NaClO + H2O
0,1..........0,05......0,05......0,05........................(mol)
Vậy :
\(C_{M_{NaCl}} = C_{M_{NaClO}} = \dfrac{0,05}{0,2}= 0,25M\\ C_{M_{NaOH}} = \dfrac{0,3-0,1}{0,2} = 1M\)

ta có 200cm3=0,2 lítn hcl=2*0,2=0,4 molgọi số mol của caco3 là a,na2co3 là bcaco3 + 2hcl -> cacl2 + co2 + h2oa(mol)---2a(mol)--a-------a--------ana2co3 + 2hcl -> 2nacl + co2 + h2ob(mol)---2b(mol)---2b-------b------bta có100a+106b=20,62a+2b=0,4=> a=b=0,1 mol=> m caco3=10g; m na2co3=10,6 g
PTHH: \(Na_2CO_3+2HCl\rightarrow2NaCl+H_2O+CO_2\uparrow\) (1)
\(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\) (2)
a) Ta có: \(\Sigma n_{HCl}=0,2\cdot2=0,4\left(mol\right)\)
Gọi số mol của Na2CO3 là \(a\) \(\Rightarrow n_{HCl\left(1\right)}=2a\left(mol\right)\)
Gọi số mol của CaCO3 là \(b\) \(\Rightarrow n_{HCl\left(2\right)}=2b\left(mol\right)\)
Ta lập được hệ phương trình:
\(\left\{{}\begin{matrix}2a+2b=0,4\\106a+100b=20,6\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{CaCO_3}=0,1\cdot100=10\left(g\right)\\m_{Na_2CO_3}=10,6\left(g\right)\end{matrix}\right.\)
b) Theo PTHH: \(\left\{{}\begin{matrix}n_{NaCl}=2n_{Na_2CO_3}=0,2mol\\n_{CaCl_2}=n_{CaCO_3}=0,1mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{NaCl}=0,2\cdot58,5=11,7\left(g\right)\\m_{CaCl_2}=0,1\cdot111=11,1\left(g\right)\end{matrix}\right.\)
Mặt khác: \(\left\{{}\begin{matrix}m_{CO_2}=0,2\cdot44=8,8\left(g\right)\\m_{ddHCl}=200\cdot1,2=240\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{dd\left(saup/ư\right)}=m_{hh}+m_{ddHCl}-m_{CO_2}=251,8\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{NaCl}=\dfrac{11,7}{251,8}\cdot100\%\approx4,65\%\\C\%_{CaCl_2}=\dfrac{11,1}{251,8}\cdot100\%\approx4,41\%\end{matrix}\right.\)




MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
nHCl = \(\dfrac{20.36,5\%}{36,5}\)= 0,2 mol => nCl2 = 0,2 : 4 = 0,05 mol
Cl2 + 2KOH →KCl + KClO + H2O
nKOH = 0,5.2 = 1 mol
=> KOH dư , Cl2 hết
nKOH dư = 1 - 0,05.2 = 0,9 mol
dung dịch A gồm KCl và KClO có số mol = nCl2 = 0,05 mol và KOH dư 0,9mol
CKCl = CKClO = \(\dfrac{0,05}{0,5}\)=0,1 M
CKOH dư = \(\dfrac{0,9}{0,5}\)= 1,8 M