Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Dung dịch chứa một chất tan có pH = 13, tức là có tính kiềm.
Theo định luật bảo toàn nguyên tố đối với K thì:

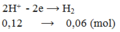
Số mol H2 do KCl sinh ra bằng: 0,04:2 = 0,02 (mol)
⟹ Số mol H2 do HCl sinh ra bằng: 0,06 – 0,02 = 0,04 (mol)
⟹ nHCl = 0,04.2 = 0,08 (mol).
Nồng độ mol/lit của HCl và KCl trong dung dịch ban đầu lần lượt bằng:
CM (HCl) = 0,08: 400 10000 = 0,2 M và CM (KCl) = 0,04: 40 1000 = 0,1 M

Đáp án C

- Sau điện phân:
+ Thể tích dung dịch NaOH ở bình 1 = 0 , 0692 2 =0,03461=34,6 ml
=> Thể tích nước bị điện phân = 40 - 34,6 = 5,4 ml
=> Số mol nước bị điện phân ở bình 1 = 5 , 4 18 = 0,3 mol
+ Bình 2:
n Cu = n H 2 O điện phân ( I ) = 0 , 3 mol ⇒ n Cu 2 + dư = 0 , 45 - 0 , 3 = 0 , 15 mol n Cl 2 = 1 2 n Cl - = 0 , 2 mol ⇒ n H 2 O điện phân ( 1 ) = 0 , 3 - 0 , 2 = 0 , 1 mol ⇒ n H + = 0 , 2 + 0 , 4 = 0 , 6 mol
- Cho 0,5 mol Fe vào dung dịch bình 2 sau phản ứng điện phân
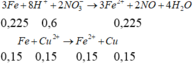
=> m = 56.(0,5-0,225-0,15)+64.0,15=16,6 gam gần với giá trị 17 nhất

Đáp án D.
Dung dịch sau có màu xanh nhạt nghĩa là vẫn còn ít ion đồng ⟹ H+ chưa bị điện phân.
Gọi số mol Cu2+ điện phân là a (mol) còn số mol O2 tạo ra ở anot là b (mol).
Bảo toàn e suy ra: a = 2b
Khối lượng dung dịch giảm gồm khối lượng Cu và khối lượng khí oxi sinh ra nên:
64a + 32b = 0,64
Từ hai phương trình trên suy ra: b = 0,004 (mol); a =0,008 (mol).
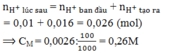

Đáp án D:
![]()
Vì dung dịch sau điện phân hòa tan được Fe3O4 nên dung dịch sau điện phân có chứa H+.
Thứ tự các phản ứng xảy ra như sau:

Các bạn có thể viết các phương trình phản ứng như trên để dễ hiểu quá trình phản ứng và tính toán theo yêu cầu đề bài. Tuy nhiên, các bạn có thể rút ngắn quá trình tính toán mà không cần viết phương trình phản ứng như sau:
Ta có các bán phản ứng:



Đáp án A
- 2 bình mắc nối tiếp nên dòng điện chạy qua có cùng cường độ
Đổi 3 phút 13 giây = 193 giây; 9 phút 39 giây = 579 giây
- Phương trình điện phân
Bình 1:
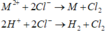
Bình 2: ![]()
+ Bình 2:
![]()
=> Chứng tỏ Ag+ còn dư sau khi điện phân 193s, có thể còn dư sau điện phân 579s
Điện phân 193s :
![]()
+ Bình 1:
![]()
=> Chứng tỏ M2+ ở bình 1 bị điện phân trước, sau khi điện phân 193s thì M2+ còn dư; sau khi điện phân 579s thì M2+ hết; H+ đã bị điện phân
Điện phân 193s:
![]()
=> M là Cu => 0,8 a = 3 , 2 64 => a = 0,0625(M)
![]()

Đáp án B
Vì dung dịch sau phản ứng hòa tan được CuO nên dung dịch sau phản ứng cần có H2SO4 :
Hai ion trực tiếp tham gia vào quá trình điện phân là Cu2+ và Cl-, sau đó nếu một trong hai ion này hết thì tại điện cực chứa sản phẩm của ion đó sẽ có H2O bị điện phân thay thế.
Khi đó khí thu được ở anot sẽ gồm Cl2, có thể có O2: 2H2O → 4H+ + O2 + 4e
Khi tại hai điện cực nước bắt đầu điện phân thì cả Cu2+ và Cl- đều bị điện phân hết.
![]()
Thứ tự các phản ứng điện phân xày ra:
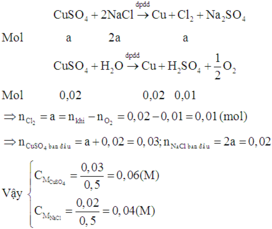

Đáp án B
Vì hai bình điện phân mắc nối tiếp nên số mol electron trao đổi ở hai bình điện phân là như nhau.
Ở hai bình đều không thấy khí ở catot thoát ra nên ở catot của hai bình chưa có sự điện phân nước.
Áp dụng định luật bảo toàn mol electron, ta có:
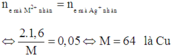

Đáp án B
Do hai bình mắc nối tiếp điện tích qua chúng không đổi, dẫn tới số mol e trao đổi của chúng bằng nhau:
![]()

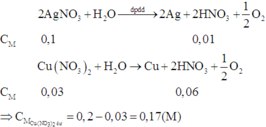

Đáp án D
Phản ứng điện phân hai dung dịch:
Vì hai bình điện phân mắc nối tiếp nên cường độ dòng điện qua hai bình điện phân là như nhau.
Do đó số mol electron trao đổi ở hai bình điện phân bằng nhau.