Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Do hai bình mắc nối tiếp điện tích qua chúng không đổi, dẫn tới số mol e trao đổi của chúng bằng nhau:
![]()

Đáp án B
Vì hai bình điện phân mắc nối tiếp nên số mol electron trao đổi ở hai bình điện phân là như nhau.
Ở hai bình đều không thấy khí ở catot thoát ra nên ở catot của hai bình chưa có sự điện phân nước.
Áp dụng định luật bảo toàn mol electron, ta có:
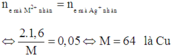

Đáp án A
- 2 bình mắc nối tiếp nên dòng điện chạy qua có cùng cường độ
Đổi 3 phút 13 giây = 193 giây; 9 phút 39 giây = 579 giây
- Phương trình điện phân
Bình 1:
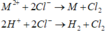
Bình 2: ![]()
+ Bình 2:
![]()
=> Chứng tỏ Ag+ còn dư sau khi điện phân 193s, có thể còn dư sau điện phân 579s
Điện phân 193s :
![]()
+ Bình 1:
![]()
=> Chứng tỏ M2+ ở bình 1 bị điện phân trước, sau khi điện phân 193s thì M2+ còn dư; sau khi điện phân 579s thì M2+ hết; H+ đã bị điện phân
Điện phân 193s:
![]()
=> M là Cu => 0,8 a = 3 , 2 64 => a = 0,0625(M)
![]()

Đáp án B
• Xét tại thời điểm th; dung dịch sau điện phân hòa tan Al sinh ra H2 mà tỷ lệ CuSO4 : NaCl = 1:1 nên.
Đặt số mol CuSO4 và NaCl đều là b mol.
Ở catot: Cu2+ + 2e → Cu0; ở anot: 2Cl- - 2e → Cl2 ; 2H2O – 4e → 4H+ + O2.
Dung dịch X Phản ứng với Al sinh ra a mol H2 → lượng H+ đã phản ứng = 2a mol.
||→ Số mol e trao đổi = b + 2a mol .
• Xét tại thời điểm 2th, số mol e trao đổi = 2 (2a + b) mol.
Ở catot: Cu2+ + 2e → Cu0 ; 2H2O + 2e → 2OH- + H2 || Ở anot: 2Cl- - 2e → Cl2 ; 2H2O – 4e → 4H+ + O2.
Số mol e Cl- nhường = b mol → số mol e H2O nhường = 4a + b mol → Lượng H+ sinh ra = 4a + b
Số mol e Cu2+ nhận = 2b mol → Số mol e H2O nhận = 4a mol → số mol OH- = 4a mol.
Trong dung dịch có OH- và H+ nên : H+ + OH- → H2O.
||→ Lượng H+ dư = b mol.
Cho Al dư vào dung dịch: Al + 3H+ → Al3+ + 3/2 H2.
||→ Số mol H2 = b /2 = 4a → a : b = 1 : 8
• Xét các nhận định:
+ Tại thời điểm 2th số mol khí thoát ra ở hai cực là: 2a + 0,5 b + 0,25 (4a + b ) , thay b = 8 a → số mol khí thoát ra = 9a mol → (1) đúng.
+ Tại thời điểm 1,75t h thì số mol e trao đổi = 1,75 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết → số mol e Cu2+ nhận = 2b mol < 1,75 (2a + b)
||→ 0,25b < 3,5a → a : b < 1 / 3 đúng (do a : b = 0,75). → (2) đúng.
+ Tại thời điểm 1,5t h thì số mol e trao đổi = 1,5 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết → số mol e Cu2+ nhận = 2b mol < 1,5 (2a + b)
||→ 0,5b < 3a → a : b < 1 / 6 → đúng (do a : b = 1:8 ). → (3) đúng.
+ Tại thời điểm 0,8t h thì số mol e trao đổi = 0,8 (2a + b) mol.
Nếu H2O điện phân thì Cl- điện phân hết → số mol e Cl- nhường= b mol < 0,8 (2a + b)
||→ 0,2b < 1,6 a → a : b < 1 / 8 đúng (do a : b = 1:8). → (4) đúng.
+ Tại thời điểm 2th thì số mol H2 sinh ra = 2a mol. → (5) sai.

Đáp án A
· Có n FeCO 3 = n CO 2 = n CaCO 3 = 24 100 = 0 , 24 mol
· Phần 1: n Al = 2 3 n H 2 = 2 3 . 0 , 06 = 0 , 04 mol
Þ Al dư, hỗn hợp rắn sau phản ứng gồm Fe, Al2O3.
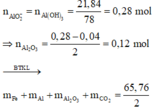 ⇒
m
Fe
=
32
,
86
-
44
.
0
,
24
2
-
102
.
0
,
12
-
27
.
0
,
04
=
14
,
28
g
⇒
n
Fe
=
0
,
255
mol
⇒
m
Fe
=
32
,
86
-
44
.
0
,
24
2
-
102
.
0
,
12
-
27
.
0
,
04
=
14
,
28
g
⇒
n
Fe
=
0
,
255
mol
· Phần 2: Đặt số mol muối Fe2(SO4)3 và FeSO4 lần lượt là x, y.
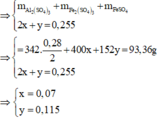
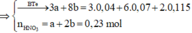
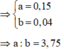

Chọn đáp án A
nCO2 = 0,24 mol. Bảo toàn khối lượng: mB = 65,76 - 0,24 × 44 = 55,2(g).
► Xét 1 phần ⇒ mB = 27,6(g). Có H2 ⇒ Al dư ⇒ B gồm Al dư, Al2O3 và Fe.
⇒ nAl = 0,06 ÷ 1,5 = 0,04 mol || nAl(OH)3 = 0,28 mol ⇒ nAl2O3 = 0,12 mol.
→ m B nFe = 0,255 mol ⇒ nSO42– = (93,36 - 0,28 × 27 - 0,255 × 56) ÷ 96 = 0,745 mol.
⇒ nH2SO4 = 0,745 mol ⇒ ∑nH+ = 0,745 × 2 + 0,23 = 1,72 mol.
● ∑nH+ = 4nNO + 10nN2O + 2nO ⇒ 4a + 10b = 1. Bảo toàn nguyên tố Nitơ:
a + 2b = 0,23 mol ||⇒ giải hệ có: a = 0,15 mol; b = 0,04 mol.
⇒ a : b = 3,75 ⇒ chọn A.

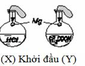
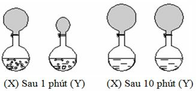
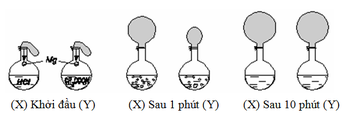

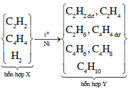
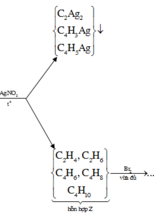
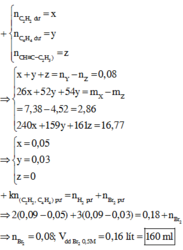

Chọn C
(1) Sau 1 phút, khí H2 thoát ra ở bình X nhiều hơn ở bình Y
(4) Sau 10 phút, khí H2 thoát ra ở 2 bình X và Y bằng nhau