Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Cu2+:x
Cl-: y
Ở catot thoát ra khí => H2O bị đp
Catot:
Cu2+ +2e → Cu
x 2x
H2O +1e → 0,5H2 + OH-
y-2x 0,5y-x
Anot:
Cl- - 1e → 0,5Cl2
y y 0,5y
=> 0,5y = 4(y-2x) => x/y=3/8
=>%mCuSO4 = 160.3/(160.3+74,5.8) = 44,61%

Chọn C.
Giả sử số mol KCl trong X là 1 mol, khi đó quá trình điện phân xảy ra như sau:Theo đề bài ta có:
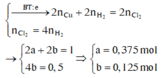
Vậy hỗn hợp X gồm CuSO4 (0,375 mol) và KCl (1 mol)
![]()

Chọn C.
Dung dịch Y có chứa OH-
![]()
Khí thoát ra ở cả 2 điện cực là H2 và Cl2 với M = 57,2

Chọn A
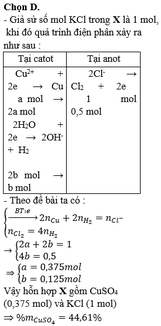
Vì: nkhí = 4,48 : 22,4 = 0,2 (mol); nAl2O3 = 15,3 : 102 = 0,15 (mol)
Có thể xảy ra:
Catot:
(1) Cu2+ + 2e → Cu
(2)2H2O + 2e → 2OH- + H2↑
Anốt
(3) Cl- → Cl2 + 2e
(4) 2H2O → 4H+ + O2 + 4e
Vì Al2O3 có thể bị hòa tan bởi OH- hoặc H+ nên có thể xảy ra 2 trường hợp sau:
TH1: Bên anot nước bị điện phân trước, không có (2) xảy ra.
Al2O3 + 6H+ → 2Al3+ + 3H2O
0,15→ 0,9 (mol)
=> nO2 = 1/4nH+ = 0,225 (mol) > 0,2 mol khí => loại
TH2: Bên catot nước bị điện phân trước, không có (4)
=> nCl2 = nkhí = 0,2 (mol) => ne trao đổi = 2nCl2 = 0,4 (mol)
Al2O3 + 2OH- → 2AlO2- + 2H2O
0,15→ 0,3 (mol)
=> nCu2+ = (0,4 – 0,3)/ 2 = 0,05 (mol)
=> m = mCuSO4 + mKCl = 0,05. 160 + 0,4. 74,5 = 37,8 (g)





Đáp án B