Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
nBa2+ = n kết tủa max = 27,58/197 = 0,14 mol (tại thời điểm nCO2 = a = 0,14)
Khi nCO2 = 0,4 mol dung dịch thu được gồm: Ba2+ (0,14 mol), HCO3- (0,4 mol) và Na+
BTĐT => nNa+ = 0,12 mol
BT e: 2nBa + nNa = 2nO + 2nH2 => nO = 0,06 mol
m = mBa + mNa + mO = 22,9 gam.

Câu hỏi này được dẫn lại từ đề thi THPTQG năm 2018 với một thí nghiệm mở màn vô cùng nguy hiểm.
Để giải được câu hỏi này, trước hết phải tính được số mol OH trong dung dịch Y bằng suy luận sau: H 2 O → H + O H
Dĩ nhiên là nhiều bạn còn đặt câu hỏi về ion AlO2- , ở đây chúng ta sẽ viết nó về Al (OH)4- = AlO2- .2H2O, lượng OH được tạo ra trong phản ứng hòa tan cũng bao gồm OH trong Al (OH)4- → nOH/Y = nH = 2nH2 = 0,0405.2= 0,081
Toàn bộ 0,081 mol OH này, một phần phản ứng với H+ và đi vào H2O (H – OH), phần còn lại đi vào kết tủa A1(OH)3.
Bảo toàn nhóm OH: nOH/Y = nOH/H2O + nOH/Al(OH)3 → 0,081=0,018.2 +0,03 + 3nAl(OH)3
→% mBaSO4 = 64,19%
Chọn đáp án A

Đáp án D
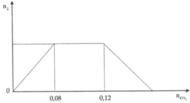
Từ đồ thị ta thấy:
nBa = a mol
nNa = 2a – a = a mol (Vì đoạn nằm ngang là NaOH phản ứng với CO2 tạo thành NaHCO3)
+ Tại nCO2=0,4a thì nBaCO3=nCO2=> 0,5=0,4a => a=1,25
+ Tại nCO2=x thì x-2a=nBaCO3 tan => x-2a=a-0,5 => x=3a-0,5=3,25
=> Ba (1,25 mol) và Na (1,25 mol)
=> m = 200 gam

Chọn A
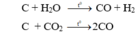
→ n C = n Y – n X = 0,4 (mol)
Bảo toàn electron có: 4. n C pư = 2 . n H 2 + 2 . n CO → n H 2 + n CO = 0,8 (mol)
n CO 2 (Y) = 0,95 – 0,8 = 0,15 mol
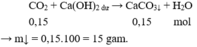



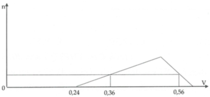




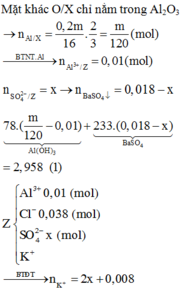
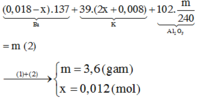

Chọn đáp án B