Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\overline{V}_{NaOH}=\left(25+25+24.9\right)\cdot\dfrac{1}{3}=\dfrac{749}{30}\left(ml\right)\)
\(\overline{V}_{CH_3COOH}=\dfrac{5+5+5}{3}=5\left(ml\right)\)
=>\(C_{CH_3COOH}=\dfrac{0.1\cdot\dfrac{749}{30}}{5}\simeq0,4993\left(M\right)\)

Hiện tượng: Phản ứng sinh ra chất lỏng, nhẹ hơn nước, có mùi thơm đặc trưng.
Giải thích bằng phương trình hoá học:
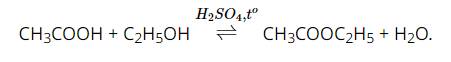

Tham khảo:
1. Quỳ tím chuyển sang màu đỏ vì acetic acid có tính acid.
2. Kim loại tan dần tạo thành dung dịch màu không màu và có khí không màu thoát ra.
- Mg + 2CH3COOH → (CH3COO)2Mg + H2
3. Tạo dung dịch không màu và có khí thoát ra.
- 2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O

Trong 50 ml dd có 1 gam acid.
Ta có: \(n_{NaOH}=0,0327.0,5=0,01635\left(mol\right)\)
\(CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\)
\(\Rightarrow n_{CH_3COOH\left(trong50ml\right)}=n_{NaOH}=0,01635\left(mol\right)\)
\(\Rightarrow m_{CH_3COOH\left(trong50ml\right)}=0,01635.60=0,981\left(g\right)\)
\(\Rightarrow\%m_{CH_3COOH}=\dfrac{0,981}{1}.100\%=98,1\%\)

1. Hiện tượng: Phản ứng sinh ra chất lỏng, nhẹ hơn nước, có mùi thơm đặc trưng.
Phương trình hoá học:
\(C_2H_5OH+CH_3COOH⇌\left(H^+,t^o\right)CH_3COOC_2H_5+H_2O\)
2. Sulfuric acid trong thí nghiệm trên vừa là chất xúc tác, vừa có tác dụng hút nước, do đó góp phần làm tăng hiệu suất tạo ester, tăng tốc độ phản ứng.

Tham khảo
-Hiện tượng: phoi bào magnesium tan, xuất hiện bọt khí.
-Giải thích: Acetic acid phản ứng với magnesium, làm magnesium tan và tạo khí hydrogen.
2CH3COOH + Mg → 2(CH3COO)2Mg + H2↑




