Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Các phương trình phản ứng
2KNO3 2KNO2 + O2↑ (1)
2KClO3 2KCl + 3O2↑ (2)
b) Theo (1) và (2), thấy số mol hai muối tham gia phản ứng như nhau nhưng số mol oxi tạo thành khác nhau và do đó thể tích khí oxi thu được là khác nhau.
Theo (1): nO2 = nKNO3 =
= 0,05 mol; VO2 = 0,05x22,4 = 1,12 lít
Theo (2): nO2 = nKClO3 =
= 0,15 mol; VO2 = 0,15x22,4 = 3,36 lít
c) Để thu được 1,12 lít khí (0,05 mol) O2, thì:
Theo (1): nKNO3 = 2nO2 = = 0,1 mol; mKNO3 = 0,1x101 = 10,1 g
Theo (2): nKClO3 = nO2 =
x0,05 mol; VKClO3 =
x0,05x122,5 = 4,086 g.

a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 4Al + 3O2 ---to→ 2Al2O3
Mol: 0,2 0,15 0,1
b) \(V_{O_2}=0,15.24,79=3,7185\left(mol\right)\)
c) \(m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ a,4Al+3O_2\underrightarrow{^{to}}2Al_2O_3\\ 0,2.......0,15........0,1\left(mol\right)\\ b,V_{O_2\left(25^oC,1bar\right)}=24,79.0,15=3,7185\left(l\right)\\ c,m_A=m_{Al_2O_3}=0,1.102=10,2\left(g\right)\)

\(nCO2=nC=\dfrac{1.76}{44}=0.04mol\)
\(nH2O=\dfrac{1}{2}nH=0.05\Rightarrow nH=0.1mol\)
\(nNH3=nN=0.02mol\)
\(nO=\dfrac{mX-mC-mN-mH}{16}=\dfrac{1.5-0.04\times12-0.02\times14-0.1\times1}{16}=0.04mol\)
C:H:N:O = 2:5:1:2
=> Công thức đơn giản nhất: (C2H5NO2)n
\(MX=\dfrac{1.5}{0.02}=75\)
=> n = 1 => C2H5NO2

a) tỉ khối của các khí với H2
\(d_{\dfrac{O_2}{H}}=32\) , \(d_{\dfrac{N_2}{H}}=28,d_{\dfrac{CO_2}{H}}=44,d_{\dfrac{O_3}{H}}=48,d_{\dfrac{SO2}{H}}=64,d_{\dfrac{H_2}{H}}=2\)
b) So với không khí
\(d_{\dfrac{O_2}{kk}}=\dfrac{32}{29}=1,1,d_{\dfrac{N_2}{kk}}=\dfrac{28}{29}=0,9655,d_{\dfrac{CO2}{kk}}=\dfrac{44}{29}=1,52,d_{\dfrac{O3}{kk}}=\dfrac{48}{29}=1,655,d_{\dfrac{SO2}{kk}}=\dfrac{64}{29}=2,21,d_{\dfrac{H2}{kk}}=\dfrac{2}{29}=0,069\)

a) Do đốt cháy A thu được H2O
=> Trong A có H
Gọi CTPT của A là RxHy (x, y nguyên dương)
\(M_{R_xH_y}=16\left(g/mol\right)\)
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\)
Bảo toàn H: nH = 1,2 (mol)
=> \(\dfrac{4,8}{16}.y=1,2\)
=> y = 4 (Tm)
\(M_{R_xH_4}=x.M_R+4=16\left(g/mol\right)\)
=> x.MR = 12
- Nếu x = 1 => MR = 12 (Cacbon)
- Nếu x = 2 => Loại
- Nếu x = 3 => Loại
- Nếu x = 4 => Loại
- Nếu x = 5 => Loại
- Nếu x = 6 => Loại
- Nếu x = 7 => Loại
- Nếu x = 8 => Loại
- Nếu x = 9 => Loại
- Nếu x = 10 => Loại
- Nếu x = 11 => Loại
- Nếu x = 12 => Loại
Vậy A là CH4
CTCT
b) \(n_{CH_4}=\dfrac{4,8}{16}=0,3\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,3-->0,6
=> \(V_{O_2}=0,6.22,4=13,44\left(l\right)\)
=> \(V_{kk}=13,44.5=67,2\left(l\right)\)

(a) Phản ứng nổ của TNT: 2C7H5N3O6 → 3N2 + 5H2O + 7CO + 7C
(b) 100 gam thuốc nổ Hexanit có chứa 60 gam TNT và 40 gam HND.
Số mol của từng chất là:
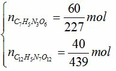
Áp dụng định luật bảo toàn nguyên tố ta có:
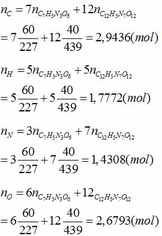
- Phần trăm khối lượng mỗi nguyên tố trong Hexanit:
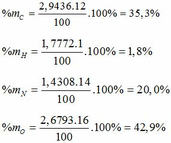
- Sản phẩm nổ của Hexanit là N2, H2O, CO, C
- Áp dụng định luật bảo toàn nguyên tố ta tính được số mol của các chất trong hỗn hợp sau khi nổ:
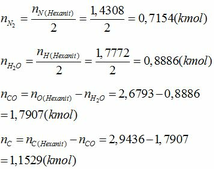
Phần trăm số mol của các chất trong hỗn hợp sau khi nổ:
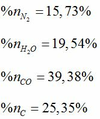


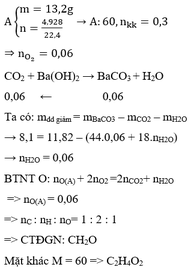

a) Chất A có tỉ khối hơi so với không khí bằng 2,07