Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A.
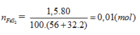
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80%
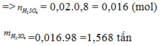

Cần bao nhiêu tấn quặng pirit sắt chứa 80% FeS2 để snar xuất 700 tấn dd H2SO4 70% biết rằng hao hụt trong sản xuất là 10%
---
mH2SO4= 700. 70%= 490(tấn)
PTHH: 4 FeS2 + 11 O2 -to,xt-> 2 Fe2O3 + 8 SO2
300_________________________________320(TẤN)
SO2+ 1/2 O2 -to-> SO3
320____________400(TẤN)
SO3 + H2O -> H2SO4
400_________490(TẤN)
mFeS2(LT)= 300(tấn)
-> mFeS2(TT)= (300.100)/90=1000/3 (tấn) (Do dư 10%)
=> m(quặng)= mFeS2(TT)/ 80% = 1000/3 : 80% \(\approx416,7\left(tấn\right)\)

Đáp án C.
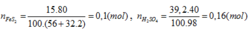
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

mFeS2=1,6.10^6.60%=960000g
=>nFeS2=960000/120=8000 mol
Sơ đồ cả quá trình tạo H2SO4
FeS2 =>2SO2 =>2SO3 =>2H2SO4
8000 mol =>16000 mol
Theo sơ đồ bảo toàn ngtố S ta có nH2SO4=8000.2.80%=12800 mol
=>mH2SO4=12800.98=1254400g=1,2544 tấn

quá trình sản xuất
FeS2-----> 2SO2------>2SO3--------->2H2SO4 (bảo toàn nguyên tố S )
120 196
4,5.80/100 ------------> x tấn H2SO4
====> x=2,88 tấn
H=90/100 ===> mH2SO4=90/100. 2,88=2,592 tấn
===> mđH2SO4= 2,592/98/100=2,65 tấn

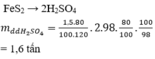


Là tên một loại quặng có thành phần chủ yếu là FeS2 nha.