Cho 0,615 gam một hỗn hợp gồm Mg và Al tác dụng với dung dịch acid HCl dư, sau phản ứng thu được 0,756 lít khí H2 (đkc). Phần trăm khối lượng của kim loại Mg có trong hỗn hợp ban đầu là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: x 1,5x
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}27x+24y=5,1\\1,5x+y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,1.27.100\%}{5,1}=52,94\%;\%m_{Mg}=100-52,94=47,06\%\)
b)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: 0,1 0,15 0,05
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: 0,1 0,1 0,1
\(m_{ddH_2SO_4}=\dfrac{\left(0,1+0,15\right).98.100}{9,8}=250\left(g\right)\)
mdd sau pứ = 5,1+250-0,15.2 = 254,8(g)
\(C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{0,05.342.100\%}{254,8}=6,71\%\)
\(C\%_{ddMgSO_4}=\dfrac{0,1.120.100\%}{254,8}=4,71\%\)

Bài 3 :
a) $Mg + H_2SO_4 \to MgSO_4 + H_2$
$n_{Mg} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$\%m_{Mg} = \dfrac{0,15.24}{13,2}.100\% = 27,27\%$
$\%m_{Cu} = 100\% -27,27\% = 72,73\%$
b) $n_{Cu} = \dfrac{13,2 - 0,15.24}{64}= 0,15(mol)$
$\Rightarrow m_{muối} = 0,15.120 + 0,15.160= 42(gam)$
Bài 4 :
Gọi $n_{Fe} = a(mol) ; n_{Mg} = b(mol)$
$56a + 24b = 18,4(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
Theo PTHH : $n_{H_2} = a + b = \dfrac{11,2}{22,4} = 0,5(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,3
$\%m_{Fe} = \dfrac{0,2.56}{18,4}.100\% = 60,87\%$
$\%m_{Mg} = 100\% -60,87\% = 39,13\%$
b) $n_{HCl} = 2n_{H_2} = 1(mol)$
$V_{dd\ HCl} = \dfrac{1}{0,8}= 1,25(lít)$

\(a.n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ Đặt:\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ \rightarrow\left\{{}\begin{matrix}27a+24b=5,1\\1,5a+b=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ \left\{{}\begin{matrix}\%m_{Al}=\dfrac{27.0,1}{5,1}.100\approx52,941\%\\\%m_{Mg}\approx47,059\%\end{matrix}\right.\)
\(b.m_{ddH_2SO_4}=\dfrac{0,25.98.100}{9,8}=250\left(g\right)\\ m_{ddsau}=m_{Al,Mg}+m_{ddH_2SO_4}-m_{H_2}=5,1+250-0,25.2=254,6\left(g\right)\\ C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{0,05.342}{254,6}.100\approx6,716\%\\ C\%_{ddMgSO_4}=\dfrac{0,1.120}{254,6}.100\approx4,713\%\)

\(a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ \Rightarrow n_{Zn}=n_{H_2}=\dfrac{3,7185}{24,79}=0.,15(mol)\\ \Rightarrow m_{Zn}=0,15.65=9,75(g)\\ \Rightarrow \%_{Zn}=\dfrac{9,75}{10}.100\%=97,5\%\\ \Rightarrow \%_{Cu}=100\%-97,5\%=2,5\%\\ b,n_{HCl}=2n_{H_2}=0,3(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{0,3.36,5}{14\%}=78,21(g)\)

\(a,n_{H_2}=\dfrac{7,437}{24,79}=0,3(mol)\\ PTHH:Mg+2HCl\to MgCl_2+H_2\\ \Rightarrow n_{HCl}=2n_{H_2}=0,6(mol)\\ \Rightarrow m_{CT_{HCl}}=0,6.36,5=21,9(g)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{21,9}{28\%}=78,21(g)\\ b,n_{Mg}=n_{H_2}=0,3(mol)\\ \Rightarrow m_{Mg}=0,3.24=7,2(g)\\ \Rightarrow {\%}_{Mg}=\dfrac{7,2}{18}.100{\%}=40\%\\ \Rightarrow {\%}_{Ag}=60\%\)

\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)

\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{20,16}{22,4}=0,9mol\)
Gọi \(\left\{{}\begin{matrix}n_{Al}=x\\n_{Mg}=y\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Al}=27x\\m_{Mg}=24y\end{matrix}\right.\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
x \(\dfrac{3}{2}x\) ( mol )
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
y y ( mol )
Ta có:
\(\left\{{}\begin{matrix}27x+24y=19,8\\\dfrac{3}{2}x+y=0,9\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,6\end{matrix}\right.\)
\(\Rightarrow m_{Al}=0,2.27=5,4g\)
\(\Rightarrow m_{Mg}=0,6.24=14,4g\)
\(\%m_{Al}=\dfrac{5,4}{19,8}.100=27,27\%\)
\(\%m_{Mg}=100\%-27,27\%=72,73\%\)

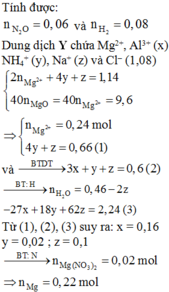

\(n_{H_2}\)= \(\dfrac{0,756}{24,79}\) = 0,0305 mol
PTHH:
Mg + 2HCl → MgCl2 + H2
Al + 3HCl → AlCl3 + \(\dfrac{3}{2}\)H2
Gọi số mol của Mg và Al lần lượt là x và y.
Ta có hệ phương trình
\(\left\{{}\begin{matrix}24x+27y=0,615\\x+1,5y=0,0305\end{matrix}\right.\)↔\(\left\{{}\begin{matrix}x=0,011\\y=0,013\end{matrix}\right.\)
⇒ mMg = 0,11 . 24 = 0,264 gam
⇒ %Mg = \(\dfrac{0,264}{0,615}\) . 100 = 43%
Phần trăm khối lượng của Mg trong hỗn hợp là 58,54%.